Összefoglaló cikk
Magyar nyelvű változata pedig innen tölthető le.
Krónikus synovitis hemofíliában:
a radiosynovectomia szerepe
Mauricio Silva, James V. Luck Jr., Adolfo Llinás
Bevezetés
Az ízületi vérzés a hemofília leggyakoribb csont-izomrendszeri megnyilvánulása. Az akut haemarthrosist az ízület gyors megduzzadása jellemzi, amelyet ízületi merevség és fájdalom előzhet meg.1 Adekvát gondozás mellett az akut haemarthrosison átesett ízület általában visszanyeri eredeti állapotát. Gyakran megfigyelhető azonban, hogy – különösen súlyos hemofíliában – az ízületi vérzés többször megismétlődik (krónikus haemarthrosis), ez pedig krónikus synovitishez, gyulladásos arthritishez és progresszív arthropathiához vezethet.2,3,1,4
A hemofíliás arthropathia sikeres megelőzésének kulcsa ezért az első haemarthrosis agresszív kezelése. Ez általában alvadási faktorok pótlásával, súlyos vérzés esetén ízületi aspiráció, resztoratív fizikoterápia és szoros klinikai monitorozás. Ha krónikus synovitis alakul ki, a hemofíliás arthropathia progressziójának lassítása, és a potenciálisan végstádiumú arthopathiát (súlyos arthritist és ízületi deformiást) eredményező nagyfokú ízületfelszíni erózió megelőzése érdekében synovectomia végzése szükséges.
Jelen monográfia célja a krónikus hemofíliás synovitis patogenezisének, klinikai jellemzőinek és kezelési lehetőségeinek áttekintése, különös tekintettel a 32P krómfoszfáttal végzett radiosynovectomiára.
A hemofíliás synovitis patogenezise
A hemofíliás synovitis kialakulása egyértelműen a vér krónikus ízületi lerakódásával áll kapcsolatban.2,3,1,4 A vér normál körülmények között nem tartozik a synovialis folyadék alkotóelemei közé. Ízületbe törő vérzés esetén a vér felgyülemlett bomlástermékeit el kell távolítani az ízületből a synovialis membránon át. A vérben nagy mennyiségben előforduló vas erős ingert jelent a synovialis sejtek számára, és gyulladásos reakciót vált ki.5,4
Az ép synovialis membrán akut, izolált haemarthrosis után képes a vér bomlástermékeit felszívni. A kora gyermekkorban előforduló izolált ízületi vérzések ezért általában csak átmeneti, nem specifikus synovialis gyulladásos elváltozásokkal járnak. Ha azonban a vérzés néhány héten belül ismételten előfordul ugyanabban az ízületben, a vér bomlástermékeinek mennyisége meghaladja a synovialis membrán felszívó képességét, és így nem tudnak kijutni a központi keringésbe. A synovialis fagocita „A” sejtek (1. ábra) vastartalmú haemosiderinnel telítettek.
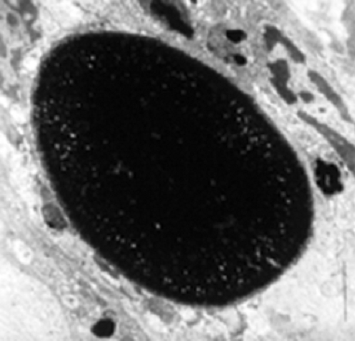
1. ábra. A synovialis fagocita „A” sejtek vastartalmú haemosiderinnel telítettek.
Ennek eredményeként a synovialis membránban krónikus gyulladás alakul ki, ennek következtében pedig térfogata megnő (synovialis hipertrófia). A synovialis szövet fokozott véráramlást igényel, hogy a vérből származó törmelék hatékonyan kiürüljön az ízületből. Emiatt a hipertrofizált synovium alatt gazdag, tágult vénás sinusoidokkal rendelkező hajszálér-hálózat alakul ki.2,6 A hipertrófiás és erősen vaszkularizált synovialis szövet (2. és 3. ábra) könnyen becsípődik az ízület felszínei közé, ez pedig fokozza az újabb vérzések kockázatát.6
|
|
|
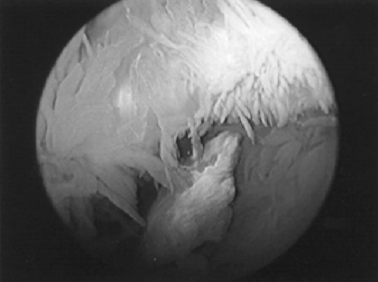
| 2. ábra: Artroszkópiás felvétel krónikus synovitisről hemofíliás beteg térdében. A synovialis membránon generalizált villusképződés és fokozott erezettség látható. |
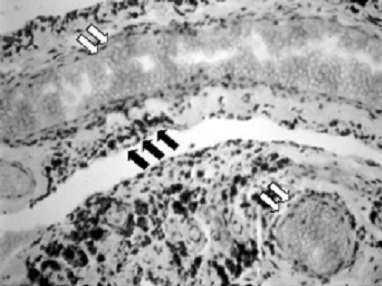
3. ábra: Krónikus synovitisről készült mikroszkópos felvétel a krónikus haemarthrosis stádiumában. A fagociták felszínén és a perivascularis sejtekben sűrű haemosiderin-lerakódás figyelhető meg (fekete nyilak). Közvetlenül a felszín alatt tágult vénás sinusoidok helyezkednek el, amelyek könnyen felszakadnak (fehér nyilak). |
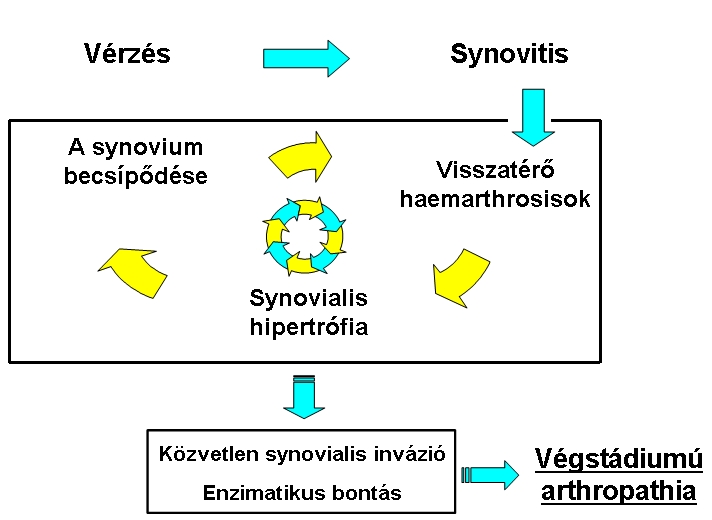
4. ábra: A haemarthrosis-synovitis-haemarthrosis krónikus, önfenntartó körforgása
Kialakul a haemarthrosis-synovitis-haemarthrosis krónikus, önfenntartó körforgása (4. ábra). Ez az ördögi kör többnyire nem áll helyre magától. Ha kialakult a krónikus synovitis, mechanikus, kémiai és enzimatikus folyamatok jelentős szerepet játszanak az ízületi porc destrukciójában, ez pedig az ízület progresszív degenerációjához vezethet.2,7,8,1,9,5,10,4 Rendkívül lényeges ezért a haemarthrosis körének lehető legkorábbi megszakítása, optimális esetben a porcdestrukció kialakulása előtt. Ha ez sikerrel jár, a beteg funkcionáló ízületekkel, minimális korlátozottsággal és jobb életminőséggel érheti el a skeletalis érettséget.
A hemofíliás arthropathia klinikai jellemzői
A haemarthrosis az ízületi érintettség legfontosabb jele hemofíliában. Minden ízületet érinthet, de leggyakrabban – csökkenő sorrendben – a térden, a könyökben, a bokán, a csípőn és a vállban alakul ki. Klinikailag a haemarthrosis akut vagy krónikus lehet.
Akut haemarthrosis
Ennek definíciója az ízületbe törő gyors vérzés. A vérzés általában traumától függetlenül történik, főként súlyos hemofíliás betegekben. Előzőleg a beteg általában merevséget, bizsergést és fájdalmat észlel1. Az ízületet a betegek flexióban tartják, hogy az ízületen belüli nyomás, és így a fájdalom a lehető legalacsonyabb legyen. Az ízület megduzzad, vörössé, érzékennyé és forróvá válik. Az akut, izolált, az egyébként egészséges hemofíliás ízületbe törő vérzés általában rövid időn belül (két hétnél kevesebb idő alatt) felszívódik, többnyire alvadási faktor alkalmazására. Az akut haemarthrosis általában nem jár másodlagos eltérésekkel a synovialis sejtekben. A gyógyulást követően a betegnél általában hosszú ideig nem jelentkezik újabb vérzés.
Krónikus haemarthrosis
Előfordul, hogy a haemarthrosis teljes felszívódása előtt újabb akut vérzésre kerül sor. Mivel a általában két hét szükséges ahhoz, hogy a synovialis membrán teljesen felszívja az akut, izolált, intraarticularis vérzés bomlástermékeit, a havi két-három akut vérzésnél több epizód meghaladja a membrán felszívóképességét. Ennek eredményeként az ízületi tér krónikusan vérrel telített lesz (krónikus haemarthrosis).
Klinikailag ez abban nyilvánul meg, hogy a betegnél egyetlen hónapon belül több akut haemarthrosis jelentkezik (fájdalom, bizsergés és merevség), ez pedig arra utal, hogy az érintett ízület sosem nyeri vissza egészséges állapotát. Az akut haemarthrosishoz hasonlóan az ízületet a beteg flexióban tartja, hogy a fájdalmat enyhítse. Mivel azonban ezt a helyzetet ilyenkor hosszabb időn át kell fenntartani, a tartós ízületi deformitás kialakulásának valószínűsége fokozódik.
A krónikus haemarthrosis korai stádiumaiban az érintett ízület fizikális vizsgálata során csak az akut vérzés jelei figyelhetők meg. Mivel a synovialis membrán hosszabb időn át érintkezik a vérrel, ez pedig a synovialis sejtek hipertrófiáját eredményezi, krónikus haemarthrosisban az ízületek fizikális vizsgálatával megvastagodott synovialis membrán észlelhető (krónikus synovitis). Az 5. ábrán hemofíliás beteg bal térdének krónikus synovitise látható.
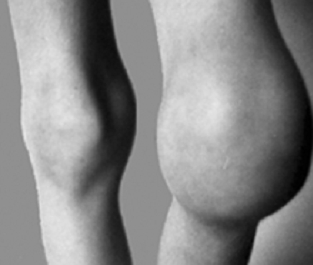
5. ábra: krónikus synovitis a bal térdben
A krónikus synovitis kezelési lehetőségei
A degeneratív arthritis sikeres megelőzésének kulcsa az első haemarthrosis gondozása a krónikus synovitis és az ízületfelszíni erózió kialakulása előtt. Az egészséges ízületbe törő akut vérzést ezért agresszívan kell kezelni, amelynek része az aspiráció, a rendszeres faktorpótlás, a resztoratív fizikoterápia és a szoros klinikai monitorozás.11
Nagyon fontos, hogy a fizikoterápia azonnal elkezdődjön, amint a beteg tolerálni tudja; végzése során ügyelni kell az újabb vérzés elkerülésére. A fizikoterápia célja az izom erősítése, a mozgástartomány helyreállítása, ill. a járásminták és a propriocepció és ízületi pozíció tudatosságának javítása.12 Az erő és a mobilitás javulása elősegíti az újabb ízületi vérzés kockázatának csökkentését. Azoknál a betegeknél, akiknél korai krónikus haemarthrosis alakult ki, rövid távú per os vagy intraarticularis szteroidkezelés kedvező hatásokkal járt: csökkent a synovium térfogata, ezáltal pedig a becsípődés kockázata.13
Profilaktikus faktorpótlás
Az ízületi vérzés korlátozására és kontrollálására tett próbálkozásként elsődleges és másodlagos profilaktikus faktorpótlási rezsimeket dolgoztak ki. Az elsődleges profilaxist a gyermek első ízületi vérzése előtt vagy röviddel azután kezdik meg; ennek során a betegek annyi alvadási faktort kapnak minden másnap vagy valamilyen más rendszer szerint, hogy a véralvadási faktorok szintje mindenkor 1% felett legyen, és így ne alakuljon ki spontán haemarthrosis és célízület.14 A másodlagos profilaxis során a cél, hogy a vérzésen már átesett ízületben további károsodások ne alakuljanak ki.15 Alvadási faktorokat naponta vagy másnaponta adnak, amíg az ízület eredeti állapota helyre nem áll. Ha azonban már kialakult a visszatérő vérzés és a krónikus synovitis, a profilaktikus faktorpótlás nem jár látványos eredménnyel. Beszámoltak róla, hogy hemofíliás synovitis mellett a betegek csak kb. 40%-ánál értek el adekvát vérzéskontrollt gondosan felügyelt alvadási faktor profilaxissal, amelyet legfeljebb 9 hónapon át, a primer profilaxishoz javasolt dózisnál magasabb adagokkal végeztek.16 A korlátozott terápiás előny mellett az ilyen kezeléssel más problémák is vannak: magasabb költségek, ill. a plazmakészítményeknek való tartós expozícióval járó kockázatok, főleg, ha azokban vírus-inaktiválást nem végeztek.
Synovectomia
Már régen felismerték, hogy a krónikus hemofíliás haemarthrosishoz a hipertrófiás, fokozottan vaszkularizált synovium is hozzájárul, és hogy az ilyen synovium eltávolítása a további ízületi károsodás megelőzésének kulcsa.17 A synovium eltávolítása sebészi és nem sebészi eljárásokkal történhet.
A. Sebészi synovectomiák
A hipertrófiás synovium sebészi kimetszése feltárásból vagy artroszkópiás módszerekkel történhet. Régebben a krónikus hemofíliás synovitis miatti synovectomiát nyitott arthrotomiával végezték. 18,3,19,20,21,22 Aprólékos sebészi munkával a synovium nagy része eltávolítható az ízületből. A nyitott synovectomia a visszatérő vérzések kontrollálásban 80%-ot meghaladó mértékben sikeres volt. A legtöbb ilyen beavatkozást azonban olyan betegeken végezték, akiknél már kiterjedt ízületfelszíni destrukció állt fenn, így végül az állapot természetes progressziója végstádiumú betegségbe torkollt. Nyitott synovectomia után sok betegeknek nehezére esett visszanyerni a mozgásterjedelmet. Emellett pedig az eljárás nagy mennyiségű faktor pótlását és tartós kórházi kezelést igényelt. Ezek miatt mára szinte teljesen eltűnt a nyitott synovectomia.
Az artroszkópia megjelenésével a nyitott eljárásokat artroszkópos synovectomia váltotta fel.23,24 A synovium eltávolítása tekintetében az artroszkópos synovectomia közel azonos mértékben eredményes, mint a nyitott műtét. A visszatérő haemarthrosis megelőzésében az artroszkópos synovectomia valamivel kevésbé sikeres, mint a nyitott eljárás. Ennél a megoldásnál azonban kevésbé jellemző a mozgásterjedelem elvesztése. Hátránya, hogy a kórházi felvételre, nagy mennyiségű alvadási faktor pótlására és intenzív fizikoterápiára itt is szükség van. Emellett pedig az inhibitorokkal rendelkező betegek nagy része nem alkalmas a sebészi synovectomiára (sem nyitott, sem artroszkópos formában).
B. Nem sebészi synovectomiák
Bizonyos anyagok az ízületbe fecskendezve képesek a synovialis szövetek térfogatának és aktivitásának csökkentésére. Ide tartozik több kémiai és radioaktív szer, amelyeket a krónikus synovitis kezelésére használnak. Az ilyen eljárások minimálisan invazívak, ezért a nem sebészi synovectomiák különösen jelentősek azoknál a hemofíliás betegeknél, akiknél inhibitorok alakultak ki az alvadási faktorokkal szemben.
B.1 Kémiai synovectomiák:
Régen thiotepa, ozmiumsav, D-penicillamin és más szerek alkalmazásával végeztek kémiai synovectomiát. Az ilyen készítmények előnye volt, hogy könnyen elérhetőek és viszonylag olcsók voltak. Alkalmazásuk azonban csekély klinikai eredményességgel járt.
Az antibiotikumként már régóta használt rifampicin jelenleg a leggyakrabban alkalmazott synovectomiás készítmény, amelyről kimutatták, hogy a haemarthrosis csökkentésében is eredményesebb.25 A rifampicint hetente egyszer intraarticularis injekcióban alkalmazzák ambulánsan, amíg a synovitis fennáll. Minden injekció után profilaktikus faktorkoncentrátum alkalmazása szükséges. A rifampicin intraarticularis injekcióban történő alkalmazásával kapcsolatban kiemelkedő eredményekről számoltak be átlagosan 2,4 év elteltével a betegek 83%-ában (synovitis nem áll fenn, és helyreállt a korábbi funkció).
Ahogy azonban súlyosbodik az ízület károsodása, a javuláshoz szükséges injekciók száma is emelkedik. Fiatalabb betegeknél és kisebb ízületeknél előnyösebb ez az eljárás. Mivel a rifampicin olcsó, könnyen elérhető és a tárolás során nem bomlik le, figyelemreméltó alternatíva lehet a krónikus hemofíliás synovitis kezelésében. Az injekciók beadása azonban fájdalommal jár, annak ellenére, hogy az ízületen általában helyi érzéstelenítőt is alkalmaznak. A megfelelő eredmény eléréséhez több injekció beadása szükséges. A módszer alkalmazására akkor kerül sor, ha hatékonyabb és fájdalmatlanabb eljárások nem elérhetőek. A szer alacsony költségével járó előnyöket csökkenti az alkalmazás többszöri megismétlésének szükségessége.
Mivel néhány fejlődő országban a rifampicin elérhetősége korlátozott, a közelmúltban Dél-Amerikában oxitetraciklin-klórhidráttal, egy széles spektrumú, szklerotizáló hatású antibiotikummal végeztek synovectomiát hemofíliás betegekben. A tapasztalatok szerint a synovitis kontrollálásában hatékonysága a rifampicinéhez hasonló, de ezt a szer is többszöri injekciózást igényel, ez pedig jelentős helyi fájdalommal jár.
B.2 Radiosynovectomiák:
A radiosynovectomia és a radiosynoviorthesis fogalmakkal szokták leírni azt az eljárást, amikor a synovium ablációját radioizotópok ízületbe injektálásával érik el. Erre a célra többféle izotópot is kipróbáltak, az ideális izotóp a következő tulajdonságokkal rendelkezik: tisztán béta-sugárzást bocsát ki, kis mélységig hatol be (hogy a hatást a synoviumon fejtse ki, és a környező szövetek irradiációjából adódó potenciális kockázat elkerülhető legyen), ill. féléletideje közepes (hogy az energia fokozatosan szabaduljon fel, és ne alakuljon ki a nagyon gyorsan lebomló izotópoknál megfigyelhető azonnali gyulladásos reakció).26 Az izotópokat megfelelő molekulaméretű hordozóhoz kell kötni, hogy a radioaktív anyag ne juthasson az ízületen kívülre, és a sugárzás és annak következményei ne érintsék a teljes szervezetet. Az ideális hordozó kb. 10 mikron méretű, nem toxikus, könnyű használni és az izotóppal azonos gyorsasággal bomlik le.
B.2.1 Az izotóp kiválasztása::
Hemofíliás betegekben többféle radioizotóppal végeztek radiosynovectomiát, pl. 198-arany, 90-yttrium, 86-rénium, 66-diszprózium és 32P-krómfoszfát. A 186-rénium és a 198-arany mellett fokozott a szisztémás felszívódás és a gamma-sugárzás miatt a kromoszómatörés kockázata, ezért mára használatuk háttérbe szorul.27,28,29,30,31,32,33,34 A 90-yttrium tisztán béta-sugárzást bocsát ki, molekulamérete és szöveti penetrációja megfelelő, így eredményesen alkalmazzák a hemofíliás synovitis kezelésére. Rövid féléletideje miatt azonban másodlagos gyulladásos reakciókat leírtak35,26,36. Jelenleg az Egyesült Államokban és Kanadában az elsőként választandó molekula a 32P-krómfoszfát, amely tisztán béta-sugárzást bocsát ki, molekulamérete 6-20 mikron, szöveti penetrációja 3-5 mm, féléletideje pedig 14 nap.37,38,39,40,41 (1. táblázat)
B.2.2 Biztonságosság:
A biztonságosság a sugárzás helyi (növekedési lemez és ízületi porc) és távoli hatásainak függvénye. Radiosynovectomia kapcsán sosem számoltak be a növekedési lemez zavarairól, még gamma-sugárzást kibocsátó izotópok alkalmazása után sem (pl. 198-arany).27,31 Az ízületi porc sugárzással szembeni rezisztenciája magas, és annak ellenére, hogy a károsodás elméletileg lehetséges, egy esetről sem számoltak be. A kezelt ízületek progresszív degenerációja ugyan bekövetkezik, de ennek üteme lassabb, mint a radiosynovectomia nélkül lenne.
A fő veszélyforrás a potenciálisan kialakuló késői, sugárzás által indukált neoplázia. A külső sugárzás hatásait részletesen vizsgálták, és ennek kapcsán kicsi a csontsarcoma indukálásának kockázata. A 32P-krómfoszfát alacsony penetrációja miatt a csont expozíciója minimális. Emellett pedig az intraarticularis térben extrém ritkán alakul ki bármilyen típusú sarcoma.
1. táblázat: A hemofíliás betegek synovectomiájában gyakrabban alkalmazott radioizotópok jellemzői
|
|
32P |
90Y |
198Au |
86Re |
165Dy |
|
Sugárzás |
β |
β |
β és γ |
β és γ |
β |
|
Molekulaméret (μ) |
6-20 |
10-20 |
3 |
0.1 |
3-5 |
|
Penetráció (mm) |
3-5 |
4-10 |
1-4 |
1-4 |
6 |
|
Féléletidő (nap) |
14 |
2,4 |
2,7 |
3,8 |
0,1 |
Az intraarticularis radioizotópok biztonságossága mellett a legerősebb érv az a több mint 5000 hosszú távon utánkövetett beteg, akiknél rheumatoid arthritis miatt végeztek radiosynovectomiát, és sugárzás által indukált malignitás egy esetben sem alakult ki.42
A radiosynovectomia után kialakuló kromoszóma-elváltozásokat részletesen vizsgálták. Habár a betegek egy nagyon kis hányadában tisztán béta-sugárzást kibocsátó izotópokkal végzett radiosynovectomia után röviddel nem specifikus kromoszóma-eltéréseket leírtak, ezek a kezelés utáni év végére eltűnnek. Még lényegesebb, hogy premalignus kromoszómaszerkezetbeli változásokat egyetlen esetben sem írtak le.29,30,14
B.2.3 Indikációk:
Az ízületi destrukció megelőzhető, ha a gyakori ízületi vérzéseket azonnal, az arthropathia indulása előtt eltávolítják. A radiosynovectomiát ezért az irreverzibilis csontdestrukció kialakulása előtt kell elvégezni. Ezen elv alapján tehát az ideális alany az olyan hemofíliás beteg, akinél gyakori a haemarthrosis (havi 2-3 vérzés) egy célízületben, akinél a faktorpótlással és fizikoterápiával végzett konzervatív kezelés nem vált be, és akinél ízületi károsodás radiológiai módszerekkel nem állapítható meg. A mindennapi gyakorlatban a hemofíliacentrumokban krónikus haemarthrosissal és synovitisszel megjelenő páciensek többségénél már kialakult valamilyen mértékű ízületi károsodás. Ez nem jelenti azt, hogy alkalmatlanok a radiosynovectomiára, de a betegeknek ilyenkor tisztában kell lenniük azzal, hogy a már jelenlévő ízületi károsodás az eljárással nem javítható. A kezelés célja az ízületi vérzés kontrollálása és a további károsodás megelőzése.
B.2.4 Az eljárás::
A radiosynovectomia ambuláns kezelésként végezhető. Néhány beteget, akinél inhibitorok mutathatók ki, egy éjszakára a kórházban tartanak a potenciális vérzés miatt. A betegek általában annyi alvadási faktort kapnak, hogy a plazmaszint a normálérték 50%-a legyen. A szerzők tudomása szerint fejlődő országokban, ahol az alvadási faktorok kevéssé hozzáférhetők, 10 NE/kg szintű alacsony dózisokkal is kielégítő eredményt értek el. Az inhibitoros betegek olyan dózisú véralvadási faktort kapnak, amely anamnesztikusan a leghatékonyabb volt a vérzéses epizódok kontrollálásában.
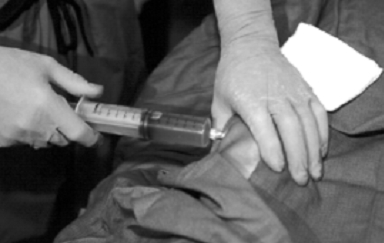
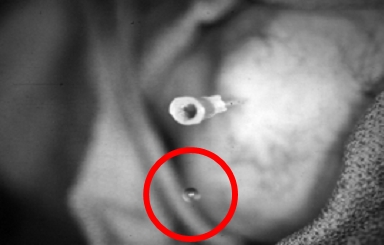
Az érintett ízületet providon-jóddal előkészítjük, és steril kendővel letakarjuk. 27 G tű alkalmazásával 1%-os xylocainnal infiltráljuk a bőrt, a szubkután szöveteket és az ízületi tokot. Adekvát anesztézia után nagyobb tűt szúrunk az ízületbe. A könyöknél és a bokánál általában 22 G, a térdnél és a vállnál általában 20 G tűt használunk. Szükség esetén nagyobb kaliberű tű is alkalmazható. A kisebb átmérőjű tűknél azonban kisebb a radioizotópok visszaáramlásának valószínűsége, különösen szubkután ízületekben. A tű intraarticularis pozicionálása rendkívül lényeges, megerősítése vér vagy synovialis folyadék aspirálásával történik (6. és 7. ábra).
|
|
|
|
6. ábra: Az izotóp injektálása előtt a lehető legalaposabban el kell távolítani a felgyülemlett vért. |
7. ábra: A tű intraarticularis pozícióját synovialis folyadék vagy vér aspirációjával kell ellenőrizni. A kör egy csepp synovialis folyadékot jelöl, amely a tűről cseppent le. |
Ha folyadék nem aspirálható, a tű intraarticularis pozíciója kontrasztanyag befecskendezésével és képerősítő alkalmazásával ellenőrizhető. Ha a tű egyértelműen az ízületi térben van, a választott radioizotópot újabb fecskendővel az ízületbe fecskendezzük. (8. ábra)
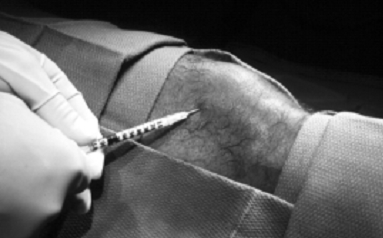
8. ábra: Újabb fecskendővel radioaktív izotópot fecskendeznek az ízületbe.
Felnőtteknél a dózis 1 mCi nagyobb (térd és váll), és 0,5 mCi kisebb ízületeknél. Gyermekeknél ezeket a dózisokat felezni kell. A radiokolloid befecskendezése után ugyanazon a tűn keresztül xylocain és dexametazon keverékét injektáljuk az ízületbe, amely a synovialis gyulladásos reakciókat minimalizálja. Miközben kihúzzuk a tűt az ízületi térből, a szúrcsatornát az érzéstelenítő-szteroid keverékkel át kell mosni, hogy az izotóp kiszivárgásának kockázata kisebb legyen. Kb. két percig nyomást kell gyakorolni az injekció helyére. Ezt követően általában kis ragtapasz elegendő a beadás helyének fedésére.
Az eljárás végeztével az ízületet teljes mozgásterjedelmében át kell mozgatni, hogy a radioizotóp a teljes synovialis felszínen eloszoljon. Az ízület flektálásakor az injekció beadásának helyére kifejtett nyomást fenn kell tartani. A kezelt ízületet két napra immobilizálni kell, a betegnek pedig tanácsolni kell, hogy tartózkodjon a megerőltető tevékenységektől két héten át.
B.2.5 A radiosynovectomia klinikai eredményei:
A 32P-krómfosztáttal végzett radiosynovectomiák több központban is hasonlóan jó klinikai eredménnyel járnak: a haemarthrosis átlagban 75%-kal csökken.37,39,40,41,43 Saját tapasztalatainkról írt beszámolónkban 130 beavatkozás eredményeit közöltük, amelyek közül 115 első, 15 pedig ismételt intervenció volt, az utánkövetésig pedig 6 hónap-12 év telt el. A haemarthrosis gyakorisága átlagosan 75-100%-kal csökkent: 80%-kal az első kezelésen átesett betegeknél, és 62%-kal az ismételten kezelteknél.41
A sebészi synovectomiákhoz képest a radiosynovectomia minimálisan invazív, ennek köszönhetően pedig javul a mozgástartomány megtartása, nem szükséges a hospitalizáció és minimális alvadási faktor alkalmazását igényli. Mivel a beavatkozások költsége szorosan összefügg a kórházi felvétel időtartamával és a szükséges alvadási faktor mennyiséggel, a radiosynovectomia sokkal olcsóbb, mint a sebészi synovectomia. Az Egyesült Államokban a radiosynovectomia átlagos költsége kb. 3000 USD, szemben a sebészi synovectomia 61 000 USD költségével.41
Áttekintés
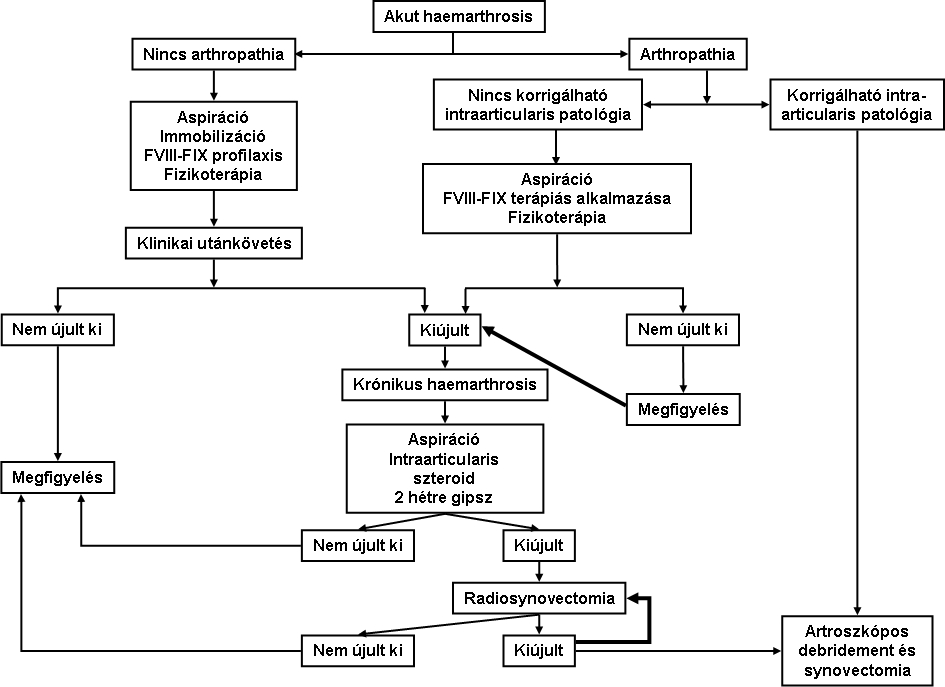
9. ábra: Akut haemarthrosis és krónikus synovitis javasolt kezelési algoritmusa
A hemofíliás arthropathia sikeres megelőzésének kulcsa az első, krónikus synovitis kialakulása előtti haemarthrosis agresszív kezelése. A 9. ábra összefoglalja az akut haemarthrosis és krónikus synovitis javasolt kezelési algoritmusát.44
Az akut haemarthrosist rendszeres faktorpótlással, resztorazív fizikoterápiával és szoros klinikai monitorozással kell kezelni. Ha azonban krónikus synovitis alakul ki (arthropathia), a hemofíliás arthropathia progressziójának lassítása és a végstádiumú arthopathia kialakulásának megelőzése érdekében synovectomia végzése szükséges.
Ha elérhető, az elsőként választandó módszer a megfelelő izotóppal végzett radiosynovectomia. Ha az izotópos synovectomia nem kivitelezhető, rifampicin alkalmazása jön szóba, megjegyzendő azonban, hogy ebben az esetben több injekció adására is szükség lehet.
Válogatott irodalomjegyzék
1. Rodriguez-Merchan EC. Pathogenesis, early diagnosis, and prophylaxis for chronic hemophilic synovitis. Clin Orthop. 1997; 343:6-11.
2. Arnold WD, Hilgartner MW. Hemophilic arthropathy. Current concepts of pathogenesis and management. J Bone Joint Surg Am.
1977; 59:287-305.
3. Luck JV, Kasper CK. Surgical management of advanced hemophilic arthropathy. An overview of 20 years’ experience. Clin Orthop.
1989; 242:60-82.
4. Stein H, Duthie RB. The pathogenesis of chronic haemophilic arthropathy. J Bone Joint Surg Br. 1981; 63:601-609.
5. Roosendaal G, Vianen ME, Wenting MJ, van Rinsum AC, van den Berg HM, Lafeber FP, Bijlsma JW. Iron deposits and catabolic properties of synovial tissue from patients with haemophilia. J Bone Joint Surg Br. 1998; 80:540-545.
6. Greene WB, McMillan CW. Nonsurgical management of hemophilic arthropathy. Instr Course Lect. 1989; 38:367-381.
7. DePalma AF. Hemophilic arthropathy. Clin Orthop. 1967; 3:145-165.
8. Niibayashi H, Shimizu K, Suzuki K, Yamamoto S, Yasuda T, Yamamuro T. Proteoglycan degradation in hemarthrosis. Intra-articular, autologous blood injection in rat knees. Acta Orthop Scand. 1995; 66:73-79.
9. Roosendaal G, TeKoppele JM, Vianen ME, van den Berg HM, Lafeber FP, Bijlsma JW. Blood-induced joint damage: a canine in vivo study. Arthritis Rheum. 1999; 42:1033-1039.
10. Speer DP. Early pathogenesis of hemophilic arthropathy. Evolution of the subchondral cyst. Clin Orthop. 1984; 185:250-265.
11. Ribbans WJ, Giangrande P, Beeton K. Conservative treatment of hemarthrosis for prevention of hemophilic synovitis. Clin Orthop. 1997; 343:12-18.
12. Buzzard BM. Physiotherapy for prevention and treatment of chronic hemophilic synovitis. Clin Orthop. 1997; 343:42-46.
13. Fernandez-Palazzi F, Caviglia HA, Salazar JR, Lopez J, Aoun R. Intraarticular dexamethasone in advanced chronic synovitis in hemophilia.
Clin Orthop. 1997; 343:25-29.
14. Nilsson IM, Berntorp E, Lofqvist T, Pettersson H. Twenty-five years’ experience of prophylactic treatment in severe haemophilia A and B. J Intern Med. 1992; 232:25-32.
15. Manco-Johnson MJ, Nuss R, Geraghty S, Funk S, Kilcoyne R. Results of secondary prophylaxis in children with severe hemophilia. Am J Hematol. 1994; 47:113-117.
16. Greene WB, McMillan CW, Warren MW. Prophylactic transfusion for hypertrophic synovitis in children with hemophilia.
Clin Orthop. 1997; 343:19-24.
17. Storti E, Traldi A, Tosatti E, Davoli PG. Synovectomy, a new approach to haemophilic arthropathy. Acta Haematol. 1969; 41:193-205.
18. DeGnore LT, Wilson FC. Surgical management of hemophilic arthropathy. Instr Course Lect. 1989; 38:383-388.
19. Post M, Watts G, Telfer M. Synovectomy in hemophilic arthropathy. A retrospective review of 17 cases. Clin Orthop. 1986; 202:139-146.
20. Rodriguez-Merchan EC, Galindo E, Ladreda JM, Pardo JA. Surgical synovectomy in haemophilic arthropathy of the knee. Int Orthop. 1994; 18:38-41.
21. Rodriguez-Merchan EC, Magallon M, Galindo E, Lopez-Cabarcos C. Hemophilic synovitis of the knee and the elbow. Clin Orthop.
1997; 343:47-53.
22. Triantafyllou SJ, Hanks GA, Handal JA, Greer RB. Open and arthroscopic synovectomy in hemophilic arthropathy of the knee. Clin Orthop. 1992; 283:196-204.
23. Eickhoff HH, Koch W, Raderschadt G, Brackmann HH. Arthroscopy for chronic hemophilic synovitis of the knee. Clin Orthop. 1997; 343:58-62.
24. Wiedel JD. Arthroscopic synovectomy of the knee in hemophilia: 10-to-15 year followup. Clin Orthop. 1996; 328:46-53.
25. Caviglia HA, Fernandez-Palazzi F, Maffei E, Galatro G, Barrionuevo A. Chemical synoviorthesis for hemophilic synovitis. Clin Orthop. 1997; 343:30-36.
26. Erken EH. Radiocolloids in the management of hemophilic arthropathy in children and adolescents. Clin Orthop. 1991; 264:129-135.
27. Ahlberg A, Pettersson H. Synoviorthesis with radioactive gold in hemophiliacs. Clinical and radiological follow-up. Acta Orthop Scand.
1979; 50:513-517.
28. Ansell BM, Crook A, Mallard J. Evaluation of intra-articular colloidal gold 198Au in the treatment of persistent knee effusions. Ann Rheum Dis. 1963; 22:435-439.
29. Falcon DV, Fernandez-Palazzi F. Cytogenetic studies in patients with hemophilic hemarthrosis treated by 198Au, 186Rh, and 90Y radioactive synoviorthesis. J Pediatr Orthop. 2000; 9:52-54.
30. Fernandez-Palazzi F, Bosch NB, Vargas AF. Chromosomal study after radioactive synoviorthesis for haemophilic haemarthrosis.
Int Orthop. 1979; 3:159-164.
31. Fernandez-Palazzi F, de Bosch NB, de Vargas AF. Radioactive synovectomy in haemophilic haemarthrosis. Follow-up of fifty cases. Scand J Haematol Suppl. 1984; 40:291-300.
32. Cibeira Fernandez-Palazzi F, Rivas S, JL, Dib O, Viso R. Radioactive synoviorthesis in hemophilic hemarthrosis: materials, techniques, and dangers. Clin Orthop. 1996; 328:14-18.
33. Lofqvist T, Petersson C, Nilsson IM. Radioactive synoviorthesis in patients with hemophilia with factor inhibitor. Clin Orthop. 1997; 343:37-41.
34. Merchan EC, Magallon M, Martin-Villar J, Galindo E, Ortega F, Pardo JA. Long term follow‑up of haemophilic arthropathy treated by 198Au-radiation synovectomy. Int Orthop. 1993; 17:120-124.
35. Dawson TM, Ryan PF, Street AM, Robertson PL, Kalff V, Kelly MJ, Cicuttini FM. Yttrium synovectomy in haemophilic arthropathy. Br J Rheumatol. 1994; 33:351-356.
36. Jahangier ZN, Jacobs JW, van Isselt JW, Bijlsma JW. Persistent synovitis treated with radiation synovectomy using 90yttrium: a retrospective evaluation of 83 procedures for 45 patients. Br J Rheumatol. 1997; 36:861-869.
37. Manco-Johnson MJ, Nuss R, Lear J, Wiedel J, Geraghty SJ, Hacker MR, Funk S, et al. 32P Radiosynoviorthesis in children with hemophilia. J Pediatr Hematol Oncol. 2002; 24:534-539.
38. Onetti CM, Gutierrez E, Hliba E, Aguirre CR. Synoviorthesis with 32P-colloidal chromic phosphate in rheumatoid arthritis--clinical, histopathologic and arthrographic changes.
J Rheumatol. 1982; 9:229-238.
39. Rivard GE, Girard M, Belanger R, Jutras M, Guay JP, Marton D. Synoviorthesis with colloidal 32P chromic phosphate for the treatment of hemophilic arthropathy. J Bone Joint Surg Am. 1994; 76:482-488.
40. Siegel HJ, Luck JV, Siegel ME, Quines C, Anderson E. Hemarthrosis and synovitis associated with hemophilia: clinical use of 32P chromic phosphate synoviorthesis for treatment. Radiology. 1994; 190:257-261.
41. Silva M, Luck JVJ, Siegel ME. 32P chromic phosphate radiosynovectomy for chronic haemophilic synovitis. Haemophilia. 2001;
7 Suppl 2:40-49.
42. Lee P. The efficacy and safety of radiosynovectomy. J Rheumatol. 1982; 9:165-168.
43. Siegel HJ, Luck JV, Jr., Siegel ME, Quinones C. Phosphate-32 colloid radiosynovectomy in hemophilia: outcome of 125 procedures. Clin Orthop. 2001; 409-417.
44. Luck JV, Silva M, Rodriguez-Merchan EC, Ghalambor N, Zahiri CA, Finn RS. Hemophilic Arthropathy: Evaluation and Management. J Am Acad Orthop Surg. 2004 ; In press.