|
NÉV: ALUMÍNIUM (alumen = “timsó”)KÉMIAI JEL: AlANYAGSZERKEZET: a.: ATOMSZERKEZET: 13 p+, 13 e–, 14 n0, 3 e–-héj, 3 külső e–b.: HALMAZSZERKEZET: Fémes kötés, fémrács. 1 mol tömege 27 gramm.FIZIKAI TULAJDONSÁGOK: KÉMIAI TULAJDONSÁGOK: 4 Al + 3 O2 ® 2 Al2O3 Híg savakban oldva, hidrogént fejleszt: 6 HCl + 2 Al ® 2 AlCl3 + 3 H2 A tömény salétromsav nem oldja (passziválódás). Az alumínium nem mérgező. ELŐFORDULÁS: 
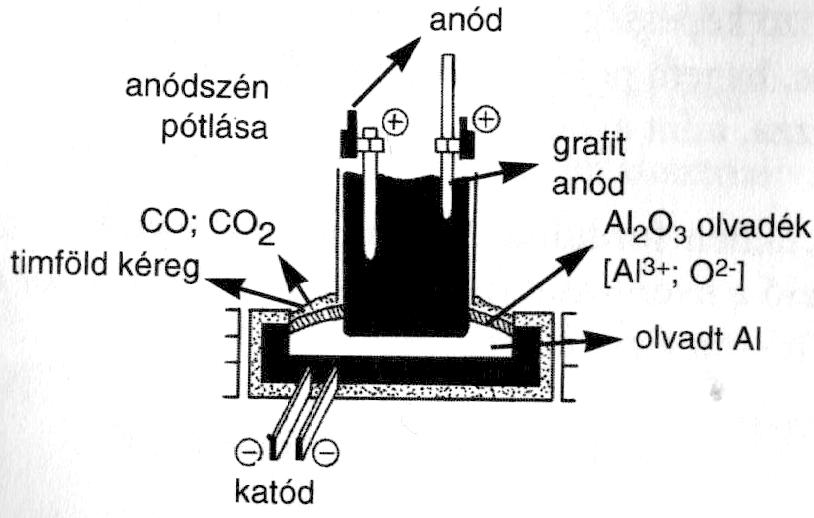
ELŐÁLLÍTÁS: 1. TIMFÖLDGYÁRTÁS A bauxitból, amely szennyezett alumínium-oxid, tiszta Al2O3-at állítanak elő. Ehhez felhasználják az Al amfoter jellemét, mert nátrium-hidroxiddal oldják ki a timföld alumínium-tartalmát.
FELHASZNÁLÁS: Jó hővezető képessége miatt háztartási edények készítésére. Jó áramvezetése miatt elektromos vezetékek anyaga. Nyújthatósága miatt alumíniumfóliák, kondenzátorok készítésére. Oxigénnel való heves reagálása miatt hegesztésre** és pirotechnikai keverékek készítéséhez. ÉRDEKESSÉGEK: 2 Al + 6 NaOH ® 2 Na2AlO3 + 3 H2 ** Az alumínium hevesen reagál az oxigénnel, azt még vegyületéből is
képes elvonni (redukálószer). Vas-oxiddal összekeverve és meggyújtva
olvadt vas keletkezik az alumínium-oxid mellett, a keletkező hővel pl. vasúti
síneket hegesztenek (termit-reakció).
|