| NÉV:
AMMÓNIA
(nitrogén-hidrid) KÉMIAI JEL:
NH3
ANYAGSZERKEZET:
a.: ATOMSZERKEZET:
N:
7 p+, 7 e–,
7 n0, 2 e–-héj, 5 külső e–
H: 1 p+, 1 e–, 0 n0, 1 e–-héj,
1 külső e–
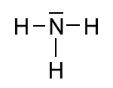
b.: HALMAZSZERKEZET:
4 atomos poláris
kovalens kötésű dipólus molekula
1 mol tömege 17 gramm. |
 |
 |
FIZIKAI TULAJDONSÁGOK:
Színtelen, szúrós szagú
gáz. Könnyebb a levegőnél. Vízben jól oldódik. Nagyon könnyen cseppfolyósítható.
KÉMIAI TULAJDONSÁGOK:
Vizes oldata a szalmiákszesz
(ammónium-hidroxid):
H2O + NH3
® NH4OH
Az ammónia vizes oldata, a szalmiákszesz lúgos kémhatású. Az oldatban
ammónium-ionok (NH4+) és hidroxid-ionok (OH–)
találhatók:
H2O + NH3
® NH4+ + OH–

Az ammónia hidrogén-klorid-gázzal szalmiáksóvá (ammónium-kloriddá)
egyesül:
NH3 + HCl
®
NH4Cl

Az ammónia mérgező gáz.
ELŐFORDULÁS:
A természetben szerves
anyagok bomlásakor jön létre (trágyadombok, wc-k, istállók).
Vegyületei közül legjelentősebbek a salétromok:
- kálisalétrom (kálium-nitrát): KNO3
- chilei salétrom (nátrium-nitrát): NaNO3
ELŐÁLLÍTÁS:
Laboratóriumban szalmiákszesz
hevítésével nyerik:

NH4OH
®
NH3 + H2O
Iparilag nitrogén és hidrogén egyesítésével (szintézissel) állítják
elő:
N2 + 3 H2
® 2 NH3
FELHASZNÁLÁS:
A cseppfolyós ammónia párolgáskor
sok hőt von el környezetétől, ezért hűtőgépek, fagyasztók, műjégpályák
hőelvonó folyadéka.
A belőle készített szalmiákszesz fontos folttisztító- és oldószer.
Az ammóniából salétromsavat és műtrágyát*, műanyagokat gyártanak.
ÉRDEKESSÉGEK:
* A legismertebb nitrogéntartalmú
műtrágyát, a pétisót ammónia és salétromsav egyesítésével nyerik:
NH3 + HNO3
® NH4NO3
Vissza
|