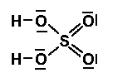KÉNSAV (hidrogén-szulfát) KÉMIAI JEL: H2SO4ANYAGSZERKEZET: O: 8 p+, 8 e–, 8 n0, 2 e–-héj, 6 külső e– S: 16 p+, 16 e–, 16 n0, 3 e–-héj, 6 külső e– b.: HALMAZSZERKEZET:
FIZIKAI TULAJDONSÁGOK: KÉMIAI TULAJDONSÁGOK: H2SO4 + 2 H2O ® SO42– + 2 H3O+ A híg sav a fémek nagy részét hidrogénfejlődés és szulfát-képződés
közben oldja: A tömény kénsav nem támadja meg a vasat (passziválódás)**. A sav lúgokkal közömbösíthető. Ekkor szulfát és víz keletkezik. A tömény kénsav erős vízelvonószer: a szerves anyagokat elszenesíti. A kénsav a szerves anyagokat roncsolja, nagyon mérgező hatású. ELŐFORDULÁS: ELŐÁLLÍTÁS: 1. A ként kén-dioxiddá oxidálják: S + O2 ® SO2 2. A kén-dioxidot kén-trioxiddá alakítják: 2 SO2 + O2 ® 2 SO3 3. A kén-trioxidot vízben elnyeletik: H2O + SO3 ® H2SO4 FELHASZNÁLÁS: ÉRDEKESSÉGEK: Cu + H2SO4 ® CuO + H2O + SO2 A kén-dioxid elszáll, a réz-oxid a többi kénsavban feloldódik, réz-szulfáttá alakul: CuO + H2SO4 ® CuSO4 + H2O ** A tömény kénsav a vasat is oxidálja, de ezt az oxidréteget már nem képes feloldani, így a tömény kénsav nem oldja a vasat. Ezért a tömény kénsav acéltartályokban tárolható, míg a híg kénsavban feloldódik.
|