NÉV: KLÓR
(klorosz = “zöld”)
KÉMIAI JEL: Cl2
ANYAGSZERKEZET:
Rendszám = 17
a.: ATOMSZERKEZET:
17 p+, 17 e–,
18 n0, 3 e–-héj, 7 külső e–
b.: HALMAZSZERKEZET:
2 atomos, apoláris kovalens
kötésű molekula
|
szerkezeti képlete: |
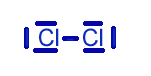 |
 |
1 mol tömege 70 gramm.
FIZIKAI TULAJDONSÁGOK:
Sárgászöld, szúrós szagú
gáz. A levegőnél kb. 2,5-szer nagyobb sűrűségű. Vízben oldódik.
KÉMIAI TULAJDONSÁGOK:
Vizes oldata fehérítő és
fertőtlenítő hatású *.
Nagyon reakcióképes elem. Fémekkel közvetlenül sókká, kloridokká egyesül.
2 Na + Cl2
®
2 NaCl

Hidrogénnel hidrogén-kloriddá
egyesül:
H2 + Cl2
®
2 HCl
A klór nagyon erős méreg.** |
 |
ELŐFORDULÁS:
Nagy reakciókészsége
miatt elemi állapotban nem fordul elő.
Leggyakoribb vegyülete a kősó (NaCl)
ELŐÁLLÍTÁS:
Laboratóriumban kálium-permanganát
és tömény sósav reakciójával.
Iparban kősó olvadék vagy oldat elektrolízisével.

FELHASZNÁLÁS:
Elsősorban fehérítő és
fertőtlenítő szerek (Hypo, klórmész) készítésére.
Sósav- és műanyag- (PVC) gyártására.
ÉRDEKESSÉGEK:
* A klóros vizet először
a világon egy magyar orvos, Semmelweis Ignác (1818-1865) ajánlotta
orvosoknak és orvostanhallgatóknak fertőtlenítő kézmosáshoz,
ezzel megakadályozta, hogy a fertőző mikroorganizmusokat maguk az
orvosok szállítsák egyik betegtől a másikhoz.
|
 |
** A klórt az első világháborúban harci gázként alkalmazták és
ezreket öltek meg vele.
Vissza
|