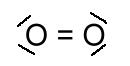|
NÉV: OXIGÉN
(Oxygenium = “savképző”)
KÉMIAI JEL: O2
ANYAGSZERKEZET:
rendszám = 8
a.: ATOMSZERKEZET: 8 p+,
8 e–, 8 n0, 2 e–-héj, 6 külső e–
b.: HALMAZSZERKEZET:
|
2 atomos, apoláris kovalens kötésű molekula,
1 mol tömege = 32 gramm
|
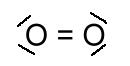 |
FIZIKAI TULAJDONSÁGOK:
színtelen, szagtalan gáz,
sűrűbb a levegőnél, vízben gyengén oldódik
KÉMIAI TULAJDONSÁGOK:
Legfontosabb kémiai
tulajdonsága, hogy az égést táplálja. Nagyon reakcióképes, így a nemfémekkel
és a fémekkel is oxidokká egyesül:
2 H2 + O2
®
2 H2O
2 Mg + O2 ® 2 MgO
Az oxigén nem mérgező gáz, az élethez nélkülözhetetlen.
ELŐFORDULÁS:
Tiszta állapotban a levegő
21 %-a. Módosulata a 3 atomos ózon (O3),
a levegőóceán tetején képződik és megvédi az élővilágot a Nap
ultraibolya sugaraitól.* Leggyakoribb vegyületei a víz (H2O), a
különböző kőzetek, ásványok, oxidok. E vegyületek a földkéreg tömegének
csaknem felét alkotják.
ELŐÁLLÍTÁS:
Laboratóriumban vízbontással:
2 H2O ®
2 H2 + O2
vagy kálium-permanganát
hevítésével, esetleg hidrogén-peroxidból nyerik:
2 H2O2
® 2 H2O + O2
Iparilag cseppfolyós levegőből nyerik.
FELHASZNÁLÁS:
Lélegzés elősegítésére.
Egyes légzési betegségek gyógyítására.
Égési folyamatok meggyorsítására, magas hőmérsékletű lángok előállítására
(hegesztés, lángvágó**)
Savak gyártására
ÉRDEKESSÉGEK:
* Az oxigén a levegőbe a
fotoszintézis során kerül. Ebben a folyamatban a növények zöld színtestjei
a Nap sugárzó energiájának felhasználásával a vizet és a szén-dioxidot
szőlőcukorrá alakítják, és melléktermékként oxigéngáz jön létre:
6 CO2 + 6 H2O ® C6H12O6
+ 6 O2
** A hidrogén-oxigén lánggal történő fémvágás feltalálói a tűzbiztos
páncélszekrények betörői voltak, akik 1896-ban alkalmazták először ezt
a módszert Hannoverben egy acélfal kivágására.
Vissza
|