NÉV: HIDROGÉN-KLORID
(sósavgáz)
KÉMIAI JEL: HCl
ANYAGSZERKEZET:
a.: ATOMSZERKEZET:
H: 1 p+, 1 e–,
0 n0, 1 e–-héj, 1 külső e–
Cl: 17 p+, 17 e–, 18 n0, 3 e–-héj,
7 külső e–
b.: HALMAZSZERKEZET:
2 atomos, poláris kovalens
kötésű molekula
|

|
 |
1 mol tömege = 36 gramm |
FIZIKAI TULAJDONSÁGOK:
Színtelen, szúrós szagú
gáz, nehezebb a levegőnél, vízben jól oldódik.
KÉMIAI TULAJDONSÁGOK:
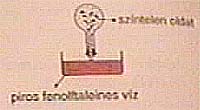 |
Vizes oldata elszínteleníti a fenolftaleint, megpirosítja a pH-papírt,
tehát savas kémhatású. A HCl vizes oldatát sósavnak nevezik. |
A savas kémhatás oka az oldatban keletkező oxonium-ionok (H 3O+)
túlsúlya:
HCl + H2O
®
Cl– + H3O+
A sósav erős sav.
Sok fémet H2
fejlődése közben old:
Zn + 2 HCl
®
ZnCl2 + H2
Mg + 2 HCl ®
MgCl2 + H2
A hidrogén-klorid gáz mérgező hatású.
ELŐFORDULÁS:
HCl-gáz a vulkáni gőzökben fordul elő. Híg vizes oldata a gyomorsavat
alkotja.
Leggyakoribb vegyületei a kloridok, a tengervíz alkotói (NaCl, KCl).
ELŐÁLLÍTÁS:
Laboratóriumban kősó
és tömény kénsav reakciójával nyerik:
2 NaCl + H2SO4
®
Na2SO4 + 2 HCl
|
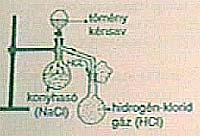 |
|

|
Iparilag hidrogéngáz és klórgáz egyesítésével nyerik:
H2 + Cl2
®
2 HCl |
FELHASZNÁLÁS:
A HCl gázt vízben oldva, sósavat
állítanak elő. A sósavat fémfelületek tisztítására, háztartásban vízkőoldásra
használják. Belőle gyártják a PVC nevű műanyagot is.
Vissza
|



