|
NÉV: VAS (ferrum = “vas”)KÉMIAI JEL: FeANYAGSZERKEZET: a.: ATOMSZERKEZET: 26 p+, 26 e–, 30 n0, 4 e–-héj, 2 külső e–b.: HALMAZSZERKEZET: Fémes kötés, fémrács. 1 mol tömege 56 gramm.FIZIKAI TULAJDONSÁGOK: KÉMIAI TULAJDONSÁGOK: Általában Fe2+ ionokat képez, erős oxidálószerekkel azonban Fe3+ ionok is létrejöhetnek. Nedves levegőn könnyen rozsdásodik. A rozsda képlete: FeOOH. Oxidrétege nem védi meg a további reakciótól. Megfelelő hőmérsékletre hevítve meggyullad és szikrázva vas-oxiddá ég el: 4 Fe + 3 O2 ® 2 Fe2O3 Híg savakban oldva, hidrogént fejleszt: 2 HCl + Fe ® FeCl2 + H2 A tömény salétromsav és kénsav nem oldja (passziválódás). A vas nem mérgező. ELŐFORDULÁS: Oxigénvegyületei nagyon gyakoriak, vegyületeiben a Föld 4. leggyakoribb eleme. Fontosabb vasércek: Mágnesvasérc (magnetit) Fe3O4 Vörösvasérc (hematit) Fe2O3 Barnavasérc (limonit) Fe2O3 * H2O Vaspát (sziderit) FeCO3 Pirit (vas-szulfid) FeS 
Az élő szervezetek vörös festékanyaga, a hemoglobin is tartalmaz vasat. ELŐÁLLÍTÁS: 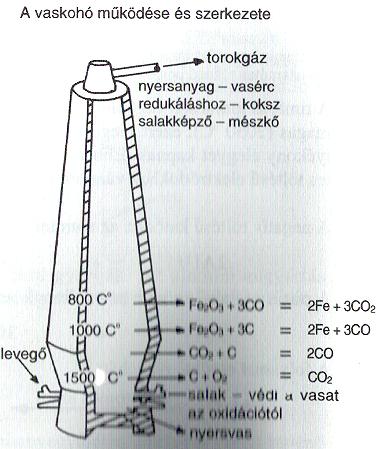
FELHASZNÁLÁS: Közlekedési eszközök készülnek belőle (vasút). Mágnesezhetősége miatt elektromágnesek, villanymotorok nélkülözhetetlen anyaga. Mivel hőtágulásának mértéke azonos a betonéval, a korszerű, vasbeton-alapú építkezések el sem képzelhetők nélküle. A vasvegyületeket a vérszegénység gyógyítására is alkalmazzák. ÉRDEKESSÉGEK:
|
