Összefoglalás - 5.
SZERVETLEN KÉMIAA szervetlen kémia a periódusos rendszer elemeivel és vegyületeikkel
foglalkozik.
1., ELEMEK
Azonos protonszámú atomok
halmazai (azonos atomokból álló anyagok). Kémiai változással nem bonthatók
egyszerűbb anyagokká. (Egy komponensű egyszerű anyagok.)
A., FÉMEK
Az Au és a Cu kivételével szürkék, fémfényűek. Szobahőmérsékleten
a Hg kivételével szilárdak. A hőt és az elektromosságot vezetik, jól alakíthatók,
megmunkálhatók. Elektronvonzó képességük kicsi, a kémiai reakciókban e –-t
adnak le, illetve + kationná alakulnak, emiatt redukáló hatásúak.
Az elemek nagy része fém. Kevés kivételtől eltekintve vegyületeikben
fordulnak elő.
B., NEMFÉMEK
Változatos színű, nem csillogó
anyagok. Többségük gáz vagy szilárd halmazállapotú. A hőt és az áramot
nem vezetik (kivéve a grafitot). A szilárdak törékenyek, nem munkálhatók
meg. Elektronvonzó képességük nagy, a kémiai reakciókban e–-t
vesznek fel, ezért kovalens kötést alkotnak, vagy – anionná alakulnak,
emiatt oxidáló hatásúak.
Az elemek kisebb részét teszik ki, elemi állapotban csak a N2, O2,
S, a C és a nemesgázok fordulnak elő.
C., FÉLFÉMEK
Átmenetet jelentenek a fémek és
a nemfémek között. (Si, Ge, As, Se).
2., VEGYÜLETEK
Halmazaikban különböző atomok
kapcsolódnak össze kémiai kötéssel. Kémiai változással keletkeznek és
bonthatók fel. Bennük az alkotó elemek tulajdonságai nem ismerhetők fel.
Alkotórészeik aránya szigorúan állandó. (Egy komponensű összetett
anyagok.)
A., OXIDOK
Az oxidok valamely elemnek oxigénnel alkotott vegyületei.
Az oxidok keletkezése oxigénnel való egyesülés (oxidáció), amely mindig
energiatermelő (exoterm) folyamat.
* Nemfémek oxidjai
Általában poláris kovalens kötésű vegyületek. Molekulákat alkotnak,
amelyek lehetnek dipólus molekulák is.
— víz (hidrogén-oxid) = H2O
— szén-monoxid = CO
— szén-dioxid = CO2
— kén-dioxid = SO2
— kén-trioxid = SO3
— nitrogén-dioxid = NO2
— foszfor-pentaoxid = P2O5 |
2 H2 + O2 ®
2 H2O
2 C + O2 ®
2 CO
C + O2 ®
CO2
S + O2 ®
SO2
2 SO2 + O2 ®
2 SO3
N2 + 2 O2 ®
2 NO2
4 P + 5 O2 ®
2 P2O5 |
* Fémek oxidjai
Általában ionos kötésű vegyületek.
Ionrácsot alkotnak, szilárdak.
— magnézium-oxid = MgO
— kalcium-oxid (égetett mész) = CaO
— alumínium-oxid (timföld) = Al2O3
— vasoxid (vörös vasérc) = Fe2O3 |
2 Mg + O2 ®
2 MgO
2 Ca + O2 ®
2 CaO
4 Al + 3 O2 ®
2 Al2O3
4 Fe + 3 O2 ®
2 Fe2O3 |
B., SAVAK
Olyan vegyületek, amelyek nemfém-oxidból
és vízmolekulából keletkeznek. A molekula víz jelenlétében H+-iont
(p+-t) képes leadni, így hidrogén-ionra és savmaradék-ionra
bomlik.
Vizes oldatuk az oxonium-ionok (H3O+) túlsúlya miatt
savas kémhatású.
* A savak keletkezése:
Víz + nemfém-oxid ®
sav
kivétel a sósav keletkezése |
H2O + SO2 ®
H2SO3 (kénessav)
H2O + SO3 ®
H2SO4 (kénsav)
2 H2O + 4 NO2 + O2 ®
4 HNO3 (salétromsav)
3 H2O + P2O5 ®
2 H3PO4 (foszforsav)
H2O + CO2 ®
H2CO3 (szénsav)
H2 + Cl2 ®
2 HCl (sósav) |
* A
savak reakciója vízzel:
Sav + víz ®
oxonium-ion + savmaradék-ion
H2SO3 + 2 H2O ®
2 H3O+ + SO32– (szulfit-ion)
H2SO4 + 2 H2O ®
2 H3O+ + SO42– (szulfát-ion)
HNO3 + H2O ®
H3O+ + NO3– (nitrát-ion)
H3PO4 + 3 H2O ®
3 H3O+ + PO43– (foszfát-ion)
HCl + H2O ®
H3O+ + Cl– (klorid-ion)
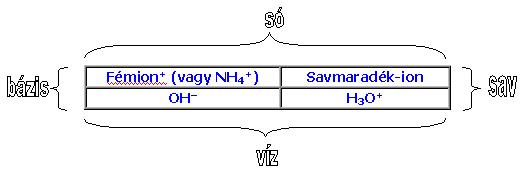
C., BÁZISOK
Fémionból (vagy az azt helyettesítő ammónium-ionból [NH 4+])
és hidroxid-ionból (OH–) álló vegyületek. Vizes oldatuk a
hidroxid-ionok miatt lúgos kémhatású, ezért a vízben oldódó bázisok a lúgok.
* Bázisok keletkezése:
— Fémek és víz reakciójával: 2 Na + 2 H2O ®
2 NaOH = nátrium-hidroxid
— Ammónia és víz reakciójával: NH3 + H2O ®
NH4OH = ammónium-hidroxid
— Fém-oxidok és víz reakciójával: CaO + H2O ®
Ca(OH)2 = kalcium-hidroxid
* Bázis és víz reakciója:
Ha a bázis oldódik vízben, fém-ionra és hidroxid-ionra esik szét (disszociál).
Ekkor az oldat kémhatása lúgos lesz: NaOH ® Na+
+ OH–.
Vízben nem oldódó bázisoknak nincs lúgos kémhatása [Al(OH)3].
D., SÓK
Ionvegyületek, amelyek fémionból és savmaradék-ionból állnak.
Tudományos nevüket a két ion nevéből képezzük.
A sók csoportosítása savmaradék-ionjaik szerint történik:
— a sósav sói a kloridok (nátrium-klorid = NaCl)
— a kénessav sói a szulfitok (kalcium-szulfit = CaSO 3)
— a kénsav sói a szulfátok (réz-szulfát = CuSO4)
— a salétromsav sói a nitrátok (ammónium-nitrát = NH4NO3)
— a foszforsav sói a foszfátok (nátrium-foszfát = Na3PO4)
— a szénsav sói a karbonátok (kalcium-karbonát = CaCO3)
A sók keletkezése:
1., Fém és halogén-elem reakciójával: Ca + Cl2 ®
CaCl2
2., Fém és sav reakciójával: Ca + 2 HCl ® CaCl2
+ H2
3., Bázis és sav reakciójával (közömbösítés): Ca(OH)2 + 2
HCl ® CaCl2 + 2 H2O
A különböző vegyületcsoportok összefüggései:
3. KEVERÉKEK
A keverékek olyan összetett (több
komponensű) anyagok, amelyekben az alkotórészek között nincs kémiai
kapcsolat. Ezért fizikai változással keletkeznek és bonthatók fel. Az alkotó
részek eredeti tulajdonságai megmaradnak, arányuk pedig változtatható.
A., GÁZKEVERÉKEK
Alkotórészeik még a legnagyobb nagyítással sem különböztethetők meg
(elegyek).
A legismertebb gázelegyek:
— levegő = 78 % nitrogén, 21 % oxigén, 1 % nemesgázok, szén-dioxid, vízpára,
stb.
— durranógáz = 66 % hidrogén, 33 % oxigén.
B., FOLYÉKONY KEVERÉKEK
Oldatok. Ezek is finom eloszlásúak (elegyek). Oldószerből és oldott
anyagból állnak. Összetételük csak bizonyos határok között változtatható.
Töménységüket úgy adjuk meg, hogy az oldott anyag tömegét viszonyítjuk
az egész oldat tömegéhez (tömeg %).
C., SZILÁRD KEVERÉKEK
Minden ásvány, érc és kőzet, valamint a fémötvözetek (acél).

Vissza *
GYAKORLÓ FELADATOK
|