12. tétel
Oxigén tartalmú szerves vegyületek csoportosítása
Az oxigén a vegyületeiben mindig két kovalens kötést létesít. Ezért a szerves molekulában hidroxil –OH, éter –O-, vagy oxo =O csoport formájában, illetve ezen funkciós csoportok kombinációi formájában épül be. A funkciós csoport a molekula tulajdonságait döntően befolyásoló atomcsoport.
Funkciós csoport:
A szerves kémiában a funkciós csoport az atomok egy molekulán belüli olyan csoportja, amely az adott molekula jellemző kémiai reakcióiért felelős. Ugyanaz a funkciós
csoport ugyanolyan vagy hasonló módon lép reakcióba, függetlenül attól, hogy
mekkora molekulában van jelen[1][2], viszonylagos reakcióképességét azonban módosíthatják a közelében
levő más funkciós csoportok.
A funkciós csoportok nevének és
az alap szénhidrogén nevének kombinálásával a szerves vegyületek elnevezésére
hatékony rendszeres nevezéktan hozható létre.
A funkciós csoportok nem hidrogén
atomjai egymáshoz és a molekula többi részéhez mindig kovalens kötéssel kapcsolódnak. Amikor atomok egy
csoportja a molekula többi részéhez elsősorban ionos kötéssel kapcsolódik, akkor a csoportot helyesebb összetett ionnak vagy
komplex ionnak nevezni.
A funkciós csoporthoz tartozó
szénatomhoz csatlakozó első szénatomot alfa szénatomnak, a másodikat béta
szénatomnak, a harmadikat gamma szénatomnak stb. nevezzük. Ha másik funkciós
csoport is kapcsolódik egy szénatomhoz, akkor használhatjuk a görög betűs
elnevezést, például a gamma-amino-vajsavban a gamma-amin a karboxilcsoporttól
számított harmadik szénatomon található.
Oxigéntartalmú
csoportok:
A C-O kötést tartalmazó
vegyületek reaktivitása eltérő, a C-O kötés helyzetétől és hibridizációjától függ, az sp2 hibridállapotú
oxigén elektronvonzó, illetve az sp3 hibridállapotú oxigén
elektrondonor sajátsága miatt.
|
Csoport |
Képlet |
Szerkezeti képlet |
Előtag |
Utótag |
Példa |
|
|
Halogénkarbonil |
RCOX |
halogénkarbonil-
(haloformil-) |
(-karbonil-halogenid) |
|
||
|
ROH |
hidroxi- |
-ol |
||||
|
RCOR' |
keto-, oxo- |
-on |
|
|||
|
RCHO |
formil-, oxo- |
-karbaldehid, -al |
|
|||
|
ROCOOR |
alkil-karbonát |
|||||
|
RCOO− |
|
-oát |
|
|||
|
RCOOH |
karboxi- |
-sav |
|
|||
|
ROR' |
alkiloxi- (alkoxi-) |
alkil-alkil-éter |
|
|||
|
RCOOR' |
aciloxi- |
alkil-...karboxilát,
alkil-alkanoát |
|
|||
|
ROOH |
hidroperoxi- |
alkil-hidroperoxid |
||||
|
ROOR |
(alkil/aril)peroxi- |
alkil-peroxid |
Hidroxivegyületek
Hidroxil (OH)-csoportot tartalmazó vegyületek (hidroxivegyületek).
Alkoholok
Az alkoholok egy vagy több hidroxilcsoportot (-OH) tartalmazó szerves vegyületek. Általános képletük: R-OH.
Nevezéktan, típusok:
Az
alkoholok neve
Szabályos nevüket a megfelelő
szénhidrogénlánc nevének végéhez illesztett -ol végződéssel képezzük.
Három-, vagy több szénatomos alkoholoknál az -ol végződés előtt fel kell
tüntetni annak a szénatomnak a számát, melyhez a hidroxilcsoport kapcsolódik.
Így a CH3-CH(OH)-CH2-CH3 vegyület szabályos
neve bután-2-ol. Egyes alkoholoknak csoportfunkciós és triviális neve is
használatos.
Rendűség,
értékűség
Az alkoholok rendűsége
annak a szénatomnak a rendűségét adja meg, amelyikhez a
hidroxilcsoport kapcsolódik. A rendűség megmutatja, hogy a hidroxilcsoporthoz
kapcsolódó szénatom hány olyan kötést alakít ki, melyekkel másik szénatomhoz
kapcsolódik. Az elsőrendű alkoholokban a hidroxilcsoporthoz kapcsolódó
szénatom 1 másik szénatomhoz kapcsolódik. A másodrendűekben ugyanez a
szénatom 2 másik szénatomhoz kapcsolódik, vagy egyhez, kétszeres kötéssel.
Az alkoholok legfeljebb harmadrendűek lehetnek.
Az alkoholok értékűségét a
bennük található hidroxilcsoportok száma határozza meg.
Típusok
és képviselőik
Etanol, a legismertebb alkohol
- A nyílt láncú alkoholok (alkil-alkoholok, vagy alifás alkoholok) a tulajdonképpeni alkoholok. Ezek hidroxilcsoportja nem mutat savas jelleget, oldatuk semleges. Az alifás alkoholok közé tartozik a legismertebb alkohol, az etanol. Igen mérgező a metanol, más néven faszesz. Ide tartoznak még a gyűrűs, de nem aromás alkoholok is.
- A fenolok (aromás alkoholok, aril-alkoholok) az alkoholoktól különálló vegyületcsoportot alkotnak. A hidroxilcsoport közvetlenül aromás gyűrűhöz kapcsolódik, és savas jelleget mutat.
Fizikai tulajdonságok:
A kis szénatomszámú alkoholok
színtelen, jellegzetes szagú folyadékok. A magasabb szénatomszámú alkoholok
szilárdak. Olvadás- és forráspontjuk a megfelelő szénhidrogénekénél, aldehidekénél és ketonokénál magasabb, mivel a legerősebb
intermolekuláris kölcsönhatás, a hidrogén-híd kialakítására képesek. A karbonsavakénál viszont alacsonyabb forrás-, ill.
olvadásponttal rendelkeznek, mivel előbbiekkel szemben molekulánként csak 1 db
hidrogénkötést tudnak létrehozni.
A kis szénatomszámú alkoholok
polárosságuk miatt jól elegyednek a vízzel, ez az alapja a különböző alkoholos
italok készítésének. Magasabb szénatomszám esetén vízben nem oldódnak. Az
összes alkohol jól oldódik etanolban és éterben.
A tiszta alkoholok, ill. azok
tiszta vizes oldata nem vezeti az áramot, mivel az alkoholok vízben nem
disszociálnak.
Kémiai tulajdonságok:
Az alkoholok vizes oldata első
közelítésben semleges, így az alkoholok a Brönsted-féle savelmélet alapján se
nem savak, se nem bázisok. Második közelítésben az alkohol vízben igen csekély
mértékben disszociál, ez azonban a pH-t jelentősen nem befolyásolja.
Alkáli- és alkáliföldfémekkel
redoxireakcióba lépnek, hidrogén képződése közben:
2 R-OH + 2 Na = 2 R-O- + 2 Na+ + H2
A képződő R-O- iont
alkoholátionnak nevezzük.
Cseppfolyós alkoholokban szilárd
kálium- vagy nátrium-hidroxidot oldva kálium- és nátrium-alkoholát képződik.
R-OH + NaOH = R-ONa + H2O
Alkoholokat melegítve kb.
130 °C-on az alkoholnak megfelelő szimmetrikus éter és víz képződik:
2 R-OH = R-O-R + H2O
Magasabb hőmérsékleten, kb.
160 °C-on vízkilépéssel az alkohol láncának megfelelő alkén keletkezik:
R-CH2-CH2-OH = R-CH═CH2 + H2O
Az alkoholok enyhe oxidáció
hatásra (pl. forró réz-oxid) megfelelő oxovegyületté (a primer alkoholok aldehiddé, a szekunderek ketonná) alakulnak át:
R-CH2OH + CuO = R-CH═O + Cu + H2O
Erősebb oxidációs hatásra
megfelelő karbonsav, vagy szén-dioxid keletkezik.
Karbonsavakkal vízkilépéssel észtereket képeznek:
R1-OH + R2-COOH = R2-C(═O)-O-R1
Előállítás:
Az alkoholok előállíthatók
telítetlen szénhidrogének vízaddíciójával, ill. alkoholátok vízben való
oldásával:
CH2═CH2 + H2O = CH3-CH2-OH
R-ONa + H2O = R-OH + NaOH
Előfordulás, felhasználás:
A természetben számos alkohol
megtalálható az erjedő növényi anyagokban. Kötött állapotban a különböző
gyümölcsök, viaszok, illóolajok tartalmazzák őket észtereik formájában. Az etil-alkoholt italok készítésére használják. A metanolt szerves oldószerként alkalmazzák.
Fenolok
A fenolok a szerves vegyületek egy csoportját alkotják. Olyan hidroxilcsoportot (vagy hidroxilcsoportokat) tartalmazó aromás vegyületek, amelyekben a hidroxilcsoportok közvetlenül az aromás gyűrűhöz kapcsolódnak. A csoport neve a legegyszerűbb ide tartozó vegyület nevéből, a fenoléból ered. A fenolok szerkezetüket tekintve a tercier (harmadrendű) alkoholokra emlékeztetnek, a kémiai tulajdonságaik viszont eltérnek az alkoholok tulajdonságaitól. Fontos különbség például, hogy a fenolok kifejezetten savjellegű vegyületek. Az aromás gyűrűhöz kapcsolódó hidroxilcsoportok száma alapján egyértékű, kétértékű és többértékű fenolokat különböztetnek meg.
Fizikai tulajdonságaik:
A fenolok általában színtelen,
kristályos vegyületek, de lehetnek folyékony halmazállapotúak is. Forráspontjuk magas. Jellegzetes, átható szagú
vegyületek. A legtöbb fenol alkoholban és éterben jól oldódik. Néhány monociklusos (egy gyűrűt tartalmazó) fenol
vízben is jól oldható. Vízoldhatóságuk általában a hidroxilcsoportok számával
növekszik.
Kémiai tulajdonságaik:
Savi
jelleg
A fenolok kifejezetten savjellegű
vegyületek, sokkal könnyebben disszociálnak vizes oldatban, mint az alkoholok.
![]()
Erős bázisokkal (például nátrium-hidroxid) sókat képeznek. A fenolok sóit fenolátoknak nevezik.
![]()
A fenolok azonban gyenge savak, a
sóik vizes oldatban könnyen hidrolizálnak. Általában gyengébb savak, mint a szénsav, ezért nem képeznek sókat az alkálifémek karbonátjaival, sőt a szénsav az alkáli-fenolátokból
felszabadítja a fenolt.
![]()
A benzolgyűrűhöz kapcsolódó halogéneket vagy nitrocsoportokat (–NO2) tartalmazó fenolok
általában lényegesen erősebb savak. Például a pikrinsav (trinitro-fenol) már az ásványi savakhoz hasonló erősségű sav.
Fenoléterek,
fenolészterek
A fenolok az alkoholokhoz
hasonlóan az alkoholokkal étereket, a karbonsavakkal észtereket képeznek.
A fenolok hidroxilcsoportja
viszonylag könnyen éteresíthető. Például metil-éterré alakíthatóak dimetil-szulfáttal vagy diazometánnal. A fenoléterek tulajdonságai az
alifás éterek tulajdonságaira emlékeztetnek. Stabil vegyületek, éterkötésük
csak erélyes behatásra bomlik el. Számos, a növényvilágban elterjedt vegyület
tartozik a fenoléterek közé. Különösen a metoxicsoportot tartalmazók a
jelentősek.
A fenolészterek közvetlen
észteresítéssel nem nyerhetőek, viszont acilezőszerekkel (például
savkloridokkal) előállíthatók.
Élettani hatásuk:
A fenolok általában mérgező
hatású vegyületek. Sejtmérgek, a fehérjéket kicsapják. E tulajdonságuk miatt baktériumölő és gombaölő
szerként alkalmaznak bizonyos fenolokat.
Előfordulásuk:
A fenolok megtalálhatóak a kőszénkátrányban és más kátrányféleségekben. A
növényvilágban is igen elterjedtek. Például számos illóolajban találhatók fenolok és fenoléterek. A növényekben nagy
mennyiségben előforduló lignin lebontásakor is keletkeznek
fenol típusú vegyületek. Fenolos hidroxilcsoportokat tartalmaznak a katechinek
és egyes növényi pigmentek (flavonoidok, antociánok) is.
Előállításuk:
Fenolos hidroxilcsoportokat
tartalmazó vegyületek állíthatók elő az aromás szulfonsavak alkáliömlesztésével. Ezzel a
módszerrel egy- és többértékű fenolok is előállíthatók.
![]()
Az aril-halogenidek
(halogéntartalmú aromás vegyületek, amelyekben az aromás gyűrűhöz halogén
kapcsolódik) lúgos hidrolízissel fenolokká alakíthatók. Ekkor a halogén
hidroxilcsoportra cserélődik. (X Cl, Br vagy I lehet)
![]()
Felhasználásuk:
Fertőtlenítő hatásuk miatt
gyógyszerek készítésére, emellett festékek és robbanószerek gyártására használják a fenolokat.
Éterek
Az éterek olyan szerves
vegyületek, melyek molekuláiban található olyan oxigénatom, mely két szénatomot (szénhidrogéncsoportot) köt
össze. A köznapi nyelvben éternek nevezzük a dietil-étert.
A nyílt láncú éterek lehetnek
szimmetrikusak vagy vegyesek aszerint, hogy az oxigénatomhoz kapcsolódó két
csoport azonos vagy különböző. Az éterek elnevezése az oxigénatomhoz kapcsolódó
szénhidrogéncsoportok nevéből és az éter szóból tevődik össze. A két
szénhidrogéncsoport nevét abc-rendben kell felsorolni az "-éter" szó
előtt (pl. dimetil-éter, etil-vinil-éter... stb.).
Molekulaszerkezet:
Az oxigénatom tetraéderes
vegyértékelektronpár elrendeződésével jól beleillik a szénláncba, nem
befolyásolja jelentősen alakját. Az éterekben lévő C-O kötések polárisak, és
emiatt az egész molekula kismértékben poláris (dipólusos).
Fizikai tulajdonságok:
A kisebb szénatomszámú éterek folyadékok (kivéve a dimetil-étert, amely gáz halmazállapotú). A nagyobb
szénatomszámúak (17-18-tól) kristályosak. Forráspontjuk lényegesen alacsonyabb a megfelelő alkoholokénál, amelyekkel konstitúciós izomerek. Ennek az az oka, hogy az
étermolekulák nem tudnak hidrogénkötést létesíteni egymással. Fizikai
tulajdonságaik ezért inkább a szénhidrogénekéhez hasonlóak. Az étermolekulák
között ugyanis a diszperziós kölcsönhatások mellett csak nagyon gyenge
dipólus-dipólus kölcsönhatás lép fel.
Előállítás:
Az éterek az alkoholok fontos
származékai. Az alkoholokból vízelvonással éterek nyerhetők, vízelvonószerként
savat (kénsavat, foszforsavat) alkalmaznak. Az etil-alkohol tömény kénsav
hatására kb. 130 Celsius-fokra melegítve víz kilépése közben dietil-éterré
alakul.
Magasabb hőmérsékleten
(körülbelül 160 °C) azonban nem éter, hanem etén lesz a termék. Ez azt bizonyítja, hogy a kénsav és az
etil-alkohol a hőmérséklettől függően különböző módon reagál egymással. Az
alkoholokból vízelvonással csak szimmetrikus étereket célszerű előállítani.
Fontosabb éterek:
A nyílt láncú étereket az iparban
oldószerként, a gyógyászatban altató-, ill. bódítószerként alkalmazzák.
A dietil-éter (CH3CH2-O-CH2CH3)
gyorsan párolgó és rendkívül gyulladékony, alacsony forráspontú folyadék,
érzéstelenítőként alkalmazták. A VIII. Magyar Gyógyszerkönyvben aether néven hivatalos.
Sok nyílt láncú éter, mint
például a diizopropil-éter, a divinil-éter, a dimetil-éter, a dipropil-éter színtelen,
jellegzetes szagú, a nyálkahártyákat ingerlő anyag, erős narkotikus hatása van.
Előfordulás, felhasználás:
Az egyszerűbb éterek (amelyekben
az étercsoporton kívül más funkciós csoport nincs) mind mesterséges anyagok. A
kémiai laboratóriumokban is csak néhányat használnak közülük. Az egyszerű
étereket elsősorban oldószerként használják. Ilyen szempontból a dietil-éter és
a dioxán a legfontosabb.
Érdekességek:
A természetben nagyon sok olyan
vegyület található, amelyekben az étercsoport mellett más funkciós csoportok is
találhatók. A fák anyagának jelentős részét kitevő ligninben a szénhidrogéncsoportokat éterkötésű oxigénatomok kötik össze.
Így a legtöbbször óriásmolekulák jönnek létre. A fa másik alkotórésze, a cellulóz is sok éterkötésű oxigént tartalmaz. A hasis (vagy marihuana) legaktívabb hatóanyaga egy gyűrűs éter, amelyben
fenolos hidroxilcsoport is található. A hatóanyag neve: tetrahidrokannabinol (a kender latin nevéből -
cannabis - származik). A hasis a nyugati világban tiltott kábítószer, a kínaiak
már több ezer évvel ezelőtt ismerték és gyógyszerként használták.
Oxovegyületek
Az oxovegyületeket két csoportra
oszthatjuk aszerint, hogy a kettős kötésű oxigénatom - vagyis az OXOCSOPORT -
láncvégi vagy láncközi szénatomhoz kapcsolódik-e. A láncvégi szénatomhoz
kapcsolódó oxocsoportot tartalmazó vegyületek az ALDEHIDEK, a láncközi vagy
gyűrűs szénatomhoz kapcsolódó oxocsoportot tartalmazók pedig a KETONOK.
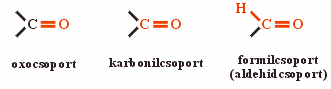
Az aldehidekre a formilcsoport
(aldehidcsoport) illetve a karbonilcsoport, a ketonokra a karbonilcsoport a
jellemző, az oxocsoport pedig mindkettőre.
Aldehidek
Az aldehidek olyan szerves vegyületek, amelyek molekulájában egy vagy több formilcsoport (aldehidcsoport) található. A formilcsoport egy oxigénatomból, egy szénatomból és egy hidrogénatomból áll.
Fizikai és
kémiai tulajdonságok:
A formaldehid szobahőmérsékleten szúrós szagú gáz,
Az acetaldehid szobahőmérsékleten forró (fp. 20,8 °C) folyadék.
A következő tagok forráspontja egyre inkább emelkedik, illatuk kellemes.
Igen reakcióképesek, könnyen polimerizálódnak, vagy oxidálódnak. Már ultraibolya sugarakkal megvilágítva bomlanak, szén-monoxid távozással, szénhidrogénekké. A karbonil csoport általában könnyen reagál.
Az aldehidek kémiai reakciói közül az alábbiakat kell megemlíteni:
a) Hidrogénnel katalizátor jelenlétében alkohollá redukálhatók:
CnH2n+1CHO + H2 -> CnH2n+1CH2OH
b) Oxidáció könnyen savakká alakítja az aldehideket. Már levegőn is oxigént vesznek fel, előbb addíciós termék keletkezik, majd egy második aldehid
molekulához csatlakozva karbonsav:
CnH2n+1CHO + O2 -> CnH2n+1CHO.O2
CnH2n+1CHO.O2 + CnH2n+1CHO
-> 2 CnH2n+1COOH
c) Alkoholokkal az aldehidek vízmentes ásványi savak jelenlétében kettős étereket, úgynevezett acetálokat alkotnak:
CnH2n+1CHO + 2 HOC2H5 -> CnH2n+1CH(OC2H5)2
+ H2O
Az acetálok kellemes virágillatúak, bor erjedésekor is keletkeznek.
Előfordulás:
A nagyobb szénatomszámú aldehidek egészen 12 szénatomig, bizonyos növények olajában, pl. citrom- és rózsaolajban
fordulnak elő.
Elnevezésük:
- A IUPAC szabályai szerint az aldehidek nevét a megfelelő szénatomszámú szénhidrogénből és az "-al" utótagból képezzük. Például a H2C=O aldehidnek a neve metanal, vagy a CH3-CH=O aldehid neve etanal.
- Az aldehidek köznapi (triviális) elnevezését annak a karbonsavnak a nevéből képezzük, amelyik az adott aldehid oxidációjából keletkezett. Például a H2C=O triviális neve formaldehid, a CH3-CH=O az acetaldehid.
- Ha elágazó láncú aldehidünk van akkor kiválasztjuk a leghosszabb szénláncot ami tartalmazza a -CHO-csoportot, és a számozást a formilcsoport szénatomjával kezdjük. CH2(CH3)-CH-CH2-CH(CH2-CH3)-CH=O szerkezetű aldehid neve 2-etil-4-metil-pentanal, igaz hogy a szerkezetében a leghosszabb szénlánc egy hexán de ez nem tartalmazza a -CH=O-csoportot.
Osztályozásuk:
Az aldehidek, a formilcsoporthoz
kapcsolódó szénhidrogéngyök természete szerint lehetnek:
- Alifásak:
- telített: CH3-CH2-CH2-CH=O (butanal vagy butiraldehid)
- telítetlen: CH2=CH-CH=O (akrilaldehid vagy akrolein)
- Aromások: C6H5-CH=O (benzaldehid)
- Vegyesek: C6H5-CH2-CH=O (fenil-acetaldehid)
Izoméria:
Az aldehidek izomérek a ketonokkal (keton: hasonló oxovegyület az aldehidhez, azzal a
különbséggel, hogy a C=O csoport a lánc közben található nem a lánc végén, pl.:
CH3-C=O-CH3, aceton) és a telítetlen alkoholokkal (pl.: CH2=CH-CH2-OH, propén-3-ol).
Kimutatásuk:
Kimutathatók ezüsttükör-próbával:
![]()
Ketonok
A ketonok láncközi
oxocsoportot (═O)
tartalmazó oxigéntartalmú szerves
vegyületek. Általános képletük: R1-CO-R2. A képletben
szereplő R1, R2 láncokat a keton
oldalláncainak nevezzük.
Szabályos nevüket a megfelelő
szénhidrogénlánc nevének végéhez illesztett -on végződéssel jelöljük. Az
-on végződés előtt feltüntetjük annak a szénatomnak a számát, amelyhez
az oxocsoport kapcsolódik. Így az aceton (CH3-CO-CH3) szabályos, genfi
nómenklatúra szerinti
neve propán-2-on. Egyes ketonoknak régies neve is használatos. A ketonok
legegyszerűbb képviselője az aceton.
Fizikai tulajdonságok:
A kisebb- és közepes
szénatomszámú ketonok jellegzetes, az éterekéhez hasonló szagú folyadékok.
Forráspontjuk az alkoholokénál és a karbonsavakénál alacsonyabb, mivel nem képesek hidrogén-híd kialakítására, viszont a szénhidrogénekénél magasabb, mivel a poláris molekulák
dipól-dipól kölcsönhatásba léphetnek egymással. A kis szénatomszámú ketonok jól
oldódnak vízben, a szénatomszám növekedésével az oldhatóság egyre csökken, az
ötös szénatomszámú ketonok már vízben gyakorlatilag nem oldódnak. Az összes
keton jól oldódik alkoholban és éterben.
Kémiai tulajdonságok:
A ketonok oldalláncai jellegük
szerint szubsztitúciós, addíciós, vagy egyéb reakciókban vehetnek részt.
A ketonok az aldehidekkel ellentétben enyhe oxidációs
hatásra nem oxidálódnak, így nem adják sem az ezüsttükör-, sem a
Fehling-próbát. Megfelelően erős oxidációs hatásra (pl. HNO3)
azonban lánchasadás mellett oxidálhatók, ekkor különféle szénatomszámú
karbonsavak keletkeznek.
Előállításuk:
A ketonok előállítása a nekik
megfelelő szekunder alkohol oxidációjával történhet. Előállíthatók továbbá a
megfelelő karbonsavak kalciumsóinak hevítésével is.














