15. tétel
Karbonsavak és sóik a szappanok
Karbonsavak
A karbonsavak az oxigéntartalmú szerves vegyületek egyik csoportját alkotják. Molekulájukban egy vagy több karboxilcsoportot tartalmaznak. A karboxilcsoport összetett funkciós csoport, egy karbonilcsoportból és egy hidroxilcsoportból épül fel. A karbonsavak savjellegű vegyületek, proton leadására képesek. A nyílt láncú, telített monokarbonsavak (egy karboxilcsoportot tartalmazó karbonsavak) homológ sort alkotnak. A legegyszerűbb képviselőjük a hangyasav, továbbiak az ecetsav, a propionsav, és a vajsav. A telített monokarbonsavak homológ sorának tagjait zsírsavaknak is szokás nevezni.
Összetett
funkciós csoport:
Ha azonos szénatomhoz két vagy több funkciós
csoport kapcsolódik, akkor azok együtt olyan új tulajdonságokkal rendelkeznek,
amelyek külön-külön egyik funkciós csoportra sem jellemzőek
Csoportosításuk:
A karbonsavak egyrészt a
karboxilcsoporthoz kapcsolódó csoport, másrészt a karboxilcsoportok száma
alapján csoportosíthatók. A karboxilcsoporthoz fűződő csoport lehet alifás, cikloalifás, aromás, heterociklusos. A karbonsavak lehetnek telítettek vagy telítetlenek. A
karboxilcsoportok száma alapján léteznek mono- (egy karboxilcsoportot
tartalmazók), di- (két karboxilcsoportot tartalmaznak), trikarbonsavak
(három karboxilcsoport található bennük). Az ecetsav például alifás telített
monokarbonsav, a fumársav alifás telítetlen dikarbonsav, a
benzoesav aromás monokarbonsav.
Fizikai tulajdonságaik:
A karbonsavak forráspontja magas, sokkal magasabb, mint a hozzájuk hasonló molekulatömegű alkánoké. Ez a karbonsavak molekuláinak asszociációjával magyarázható. A karbonsavak
karboxilcsopotja hidroxilcsoportot is tartalmaz, ezért hidrogénkötéseket tudnak kialakítani. A
karbonsavak dimereket alkotnak, két karbonsavmolekula hidrogénkötésekkel
összekapcsolódik egy nyolctagú gyűrűt alkotva. Az ecetsavmolekulák
asszociációja olyan erős, hogy az ecetsav gőzeiben is dimerek találhatók.
A karbonsavak olvadáspontjai periodikusan változnak, a páros szénatomszámú zsírsavak
olvadáspontja magasabb a páratlan számú szénatomot tartalmazókénál. Ez azzal
magyarázható, hogy a páros szénatomszámúak más szerkezetű kristályrácsban
kristályosodnak, mint a páratlanok.
A négy legkisebb szénatomszámú
karbonsav (hangyasav, ecetsav, propionsav, vajsav) vízzel korlátlanul elegyednek, bennük a karboxilcsoport hidrofil,
poláris jellege érvényesül inkább, mint a szénhidrogénlánc hidrofób, apoláris
jellege. A szénatomszám növekedésével a szénhidrogénlánc vagy gyűrű apoláros
jellege egyre erősebb lesz, a karbonsav vízoldhatósága csökken. Ha a
molekulában nincs más poláris jellegű csoport, a nyolc-kilenc szénatomos
karbonsavak vízben alig, szerves oldószerekben (alkoholban, éterben) jól oldónak.
Kémiai tulajdonságaik, karbonsavszármazékok:
A karbonsavak reakcióképes
vegyületek. Reakciókészségük egyrészt a bennük található karboxilcsoport
reakciókészségével, másrészt azzal magyarázható, hogy a karboxilcsoport
elektronvonzó hatása miatt lazítja a vele szomszédos szénatomhoz kapcsolódó hidrogénatomot vagy hidrogénatomokat.
Savi
jelleg
A karbonsavak savjellegű
vegyületek, vizes oldatban protonra és savmaradékionra disszociálnak. Az erős
szervetlen savaknál (sósav, kénsav) azonban sokkal gyengébb savak. Bázisokkal sókat képeznek. Sóik vizes oldatban hidrolizálnak, mert a karbonsavak gyenge
savak. A karbonsavak erős bázisokkal alkotott sóinak vizes oldata ezért lúgos kémhatású.
![]()
![]()
A karbonsavak disszociációjának
mértéke függ attól, hogy milyen csoport kapcsolódik a karboxilcsoporthoz. Ha a
karboxilcsoporthoz elektronszívó hatású csoport kapcsolódik, a karbonsav
erőssége nő, ha a csoport elektronküldő, elektrontaszító hatású, a sav erőssége
csökken. Az ecetsav például azért gyengébb sav, mint a hangyasav, mert benne a
karboxilcsoporthoz a hidrogénatom helyett az elektronküldő hatású metilcsoport
kapcsolódik. Viszont az ecetsavban a metilcsoporton lévő hidrogénatomok klórral
való helyettesítése a klóratomok elektronszívó hatása miatt növeli a savi
erősséget.
Észterek
keletkezése
Karbonsavak és alkoholok reakciójában észterek képződnek. Ez a folyamat a közvetlen észteresítés. Az
észterek képződése megfordítható folyamat, az észterek víz hatására könnyen
hidrolizálnak. Az észteresítés állás vagy melegítés hatására megy végbe.
![]()
Alkoholokból (és fenolokból)
nemcsak közvetlen észteresítéssel képződnek észterek, előállíthatók különböző
acilezőszerekkel (savkloridokkal, savanhidridekkel) is. Például alkoholok
savkloridokkal észterek képződése közben acilezhetők:
![]()
Acilezőszernek savanhidridek is
használhatók, ecetsavanhidrid segítségével például
ecetsavészterek állíthatók elő.
Karbonsavhaloidok
A karbonsavhaloidok a
karbonsavakból nyerhetők a karboxilcsoporton belül található hidroxilcsoport
halogénnel való helyettesítésével. A legjelentősebbek a savkloridok, ezek
karbonsavakból foszfor-pentakloriddal (PCl5) vagy tionil-kloriddal (SOCl2) állíthatók elő.
![]()
![]()
A karbonsavhaloidok
acilezőszerek, az alkoholok és az aminok acilezésére, tehát észterek és amidok előállítására használhatók. Víz hatására könnyen karbonsavvá
hidrolizálnak:
![]()
Karbonsavanhidridek
A karbonsavanhidridek a karbonsavakból keletkeznek
vízelvonással. A vízelvonás vízelvonószerek (például ecetsavanhidrid) vagy 400
°C-on katalizátorok hatására játszódik le.
![]()
Dikarbonsavakból intramolekuláris
vízelvonással gyűrűs savanhidrid állítható elő. Gyűrűs savanhidrid például a ftálsavból előállítható ftálsavanhidrid vagy a borostyánkősavból keletkező szukcinanhidrid.
Léteznek vegyes anhidridek is, ezek két különböző karbonsav közös
anhidridjeinek tekinthetők.
A savanhidridek a savkloridokhoz
hasonlóan reakcióképes karbonsavszármazékok. Főként acilezésre használják őket,
elsősorban észterek és amidok előállítására.
Karbonsavamidok
A karbonsavamidokban a
karboxilcsoportban található -OH-csoport NH2-csoportra, vagy annak
helyettesített változataira van kicserélve. A karbonsavamidok ammóniából vagy aminokból állíthatók elő acilezőszerekkel.
![]()
Savamidok keletkeznek nitrilekből
víz hatására is.
![]()
Redukció,
dekarboxilezés
A karboxilcsoport nehezen
redukálható csoport, a karbonsavakból csak erélyes redukció hatására
keletkeznek aldehidek vagy primer alkoholok.
A karbonsavak dekarboxilezése a
karboxilcsoport szén-dioxid alakjában történő eltávolítását
jelenti. A zsírsavak dekarboxilezésekor alkánok keletkeznek. A dekarboxilezés a karbonsav nátriumsójának nátrium-hidroxiddal való hevítésekor játszódik le.
![]()
Az élő szervezetben a
dekarboxilezési folyamatok enzimek hatására mennek végbe
(dekarboxiláz enzimek).
Előfordulásuk, jelentőségük:
Karbonsavak a növény- és állatvilágban is előfordulnak. A hosszabb szénláncú alifás
karbonsavak (például palmitinsav, sztearinsav, olajsav) a zsírokban és az olajokban fordulnak elő kötötten, észter
alakjában. A kisebb szénatomszámúak szabadon vagy sók alakjában találhatók meg.
Nagy biológiai jelentősége van a karbonsavak aminoszármazékainak, az aminosavaknak. Az aminosavak a fehérjék építőkövei. Más karbonsavak (például citromsav, tejsav) az anyagcsere-folyamatokban játszanak szerepet.
Előállításuk:
A karbonsavak vagy bizonyos
vegyületek oxidációjával, vagy karbonsavszármazékokból
állítható elő. Karbonsavak nyerhetők alacsonyabb oxidációs fokú vegyületek
(például szénhidrogének, alkoholok, oxovegyületek) oxidációjával.
Alkánok és alkének erélyes oxidációjakor karbonsavak keletkeznek. Ez a folyamat
láncszakadással jár. Benzol oxidációjakor maleinsavanhidrid keletkezik, ami víz
hatására maleinsavvá hidrolizál. A toluol oxidációjával benzoesav állítható elő. Naftalin oxidációjakor ftálsav keletkezik.
Aldehidek és aldehideken
keresztül primer alkoholok is karbonsavakká oxidálhatók. A szekunder alkoholok ketonokká oxidálhatók, majd a ketonok oxidációjakor lánchasadás miatt
kisebb szénatomszámú karbonsavak keletkeznek.
A karbonsavszármazékok közül az
észterek hidrolízisekor karbonsavak és alkoholok keletkeznek. A folyamat
megfordítható. A hidrolízist savval vagy lúggal végzik. A karbonsavak lúgos
hidrolízisét elszappanosításnak is szokás nevezni. A természetben nagy mennyiségben
előforduló észterek, a zsírok és az olajokból is karbonsavak nyerhetők
hidrolízissel, a karbonsav mellett glicerin keletkezik, mint alkohol.
A karbonsavszármazékok közül a savkloridok
és a savanhidridek víz hatására könnyen karbonsavakká hidrolizálnak.
Nitrilekből savamidokon át is előállíthatók karbonsavak.
![]()
![]()
Hangyasav
A hangyasav a
legegyszerűbb karbonsav. Képlete: CH2O2,
vagy HCOOH.
A természetben megtalálható a
hártyásszárnyú rovarok harapásaiban és csípéseiben,
beleértve a méheket és a hangyákat, valamint fontos égési terméke az átlagtól eltérő üzemanyagú autóknak, amelyek metanollal működnek (vagy etanollal, ha vízzel szennyeződnek) és benzinnel vannak keverve. Nevét onnan kapta, hogy először hangyák desztillálásával jutottak hozzá. Bázisokkal képzett sóit és észtereit formiátnak (metanoátnak) hívják. A formiát ion képlete:
HCOO−.
Tulajdonságai:
A hangyasav korlátlanul elegyedik
vízzel, és sok poláros szerves oldószerben is oldódik, valamelyest a szénhidrogénekben is oldódik. Szénhidrogénekben és gázfázisban
a hangyasav többnyire hidrogénkötésekkel összekapcsolódott dimerekből
áll, semmint külön molekulákból. Gőzének viselkedése emiatt jelentősen eltér a tökéletes gázok törvénye alapján várttól. Folyékony és
szilárd halmazállapotban a hangyasav a molekulák szinte végtelen
hidrogénkötés-rendszerének hálózatából áll. A hangyasav sokban hasonlít a többi
karbonsavra, de normál körülmények között nem képez savkloridot vagy savanhidridet. Hevítés vagy erős vízelvonószer
(például tömény kénsav) hatására szén-monoxidra és vízre bomolhat. Mutatja az aldehidek némely redukciós reakcióját is. A karbonsavak közül egyedi az alkénekkel való addíciós reakciókészsége, amikor is hangyasav-észter
keletkezik. Bizonyos savak jelenléte esetén azonban, beleértve a kénsavat és a hidrogén-fluoridot, a Koch-reakció egy változata megy végbe, a
hangyasav az alkénre addíciónál, és nagyobb szénatomszámú karbonsav keletkezik.
Előállítás:
A hangyasav nagy mennyiségben
keletkezik más vegyületek, elsősorban az ecetsav előállításának melléktermékeként. Ez az előállítási mód azonban
nem fedezi a mai hangyasav szükségletet. Metanol és szén-monoxid erős bázis jelenlétében végzett
reakciójában egy hangyasav származék, metil-formiát keletkezik:
CH3OH + CO → HCOOCH3
Az iparban ezt a reakciót folyadék halmazállapotban, magas nyomáson hajtják végre. A szokásos
reakciókörülmények 80 °C és 40,5 bar. A legtöbbször használt bázis a nátrium-metoxid. A metil-formiát hidrolízise hangyasavat eredményez:
HCOOCH3 + H2O → HCOOH + CH3OH
Ahhoz, hogy a metil-formiát
közvetlen hidrolízise hatékony legyen, hatalmas
mennyiségű víz szükséges, ezért egyes gyártók közvetett előállítási módszert
alkalmaznak. A metil-formiátot ammóniával reagáltatva formamidot állítanak elő, és ezt kénsavval hidrolizálva kapnak hangyasavat:
HCOOCH3 + NH3 → HCONH2 + CH3OH
HCONH2 + H2O + ½H2SO4 → HCOOH + ½(NH4)2SO4
Ezzel a módszerrel is van
probléma, főleg az ammónium-szulfáttól való megszabadulás. Ezért
mostanában energiatakarékosabb utakat keresnek az első megoldáshoz.
Felhasználás:
A hangyasav fő felhasználása a
közéletben tartósítószerként és antibakteriális anyagként történik. Szénára és
takarmányra fecskendezve megállít bizonyos bomlási folyamatokat, megőrizve a
tápanyagokat hosszabb ideig. Néha szalmonella baktérium megölésére is
alkalmazzák.
Oxálsav
Oxálsav, más néven: sóskasav, etán-disav. Két bázisú (azaz besorolása: dikarbonsav), széntartalmú organikus sav, amelyet Savary fedezett fel 1773-ban. Sói az oxalátok.
Tulajdonságai:
Fehér kristályos vegyület. Az
oxálsav egyhajlású prizmákban kristályosodik, amelyek két molekula
kristályvizet tartalmaznak (H2C2O4·2
H2O). Vízben és alkoholban könnyen oldódik
(2 sr. kristályos oxálsav szobahőmérsékleten 9 sr. vízben feloldódik), oldata
erősen savanyú ízű és savas kémhatású. Oxidáló anyagok (káliumpermanganát) igen
könnyen széndioxiddá és vízzé oxidálják, ezért az oxálsav egyike az erélyesebb
redukáló anyagoknak. Az iparban a karton-, selyem- és gyapotfestészetben, a
kémiai laboratóriumokban pedig normál (szabályos) oldatok készítésére és a
különféle oxálsavsók előállítására használják. Nagyobb adagban a szervezetre
mérgező hatású. Az oxálsav legegyszerűbben felismerhető mészvízzel, amellyel
fehér, ecetsavban oldhatatlan csapadékot ad. Mennyiségi meghatározása leginkább
káliumpermanganát oldattal történik titrálás útján. Analitikai kémiában egyik
legelterjedtebb titeralapanyag, mivel 99,9 %-os tisztaság is elérhető.
Legtöbb esetben lúgok mennyiségi meghatározására használják. Érdekessége hogy
ez volt az első szerves anyag amit szervetlen anyagokból állítottak elő, és
ezzel bizonyítva hogy az élő szervezetre a szervetlen környezet hatással is
hatással van biokémiai területen. Nemsokkal előállítása után elkezdődhetett a
szerves és szervetlen kémia ötvözése. Szervetlen anyagokból szerves molekulák
szintetizálása, amely folyamat a gyógyszeripar egyik alappillére lett a XXI.-ik
századra.
Előfordulása:
Előfordul a sóskában, spenótban
és számos más növényben (az oxalis- és a rumex-féle fajokban), azonkívül az
állati szervezetben (a húgyban) részint szabad állapotban, részint különféle
sók alakjában. Kalciumsója a vesekő leggyakoribb alkotója. A természetben
található humboltin nevű ásvány nem egyéb, mint vas(II)-oxalát, a whewellit
pedig kalcium-oxalát. Oxálsav képződik igen sok széntartalmú vegyület
oxidációjakor, így a cukorféleségeknek, a szénhidrátoknak, stb. salétromsavval
való oxidálásakor.
Kalcium sója vízben oldhatatlan
(ezért okozhat vesekövet). Savanyú kálium sója (HOOC-COOK) a rozsdafoltot
eltávolítja.
Reakcióképessége, reakciói:
Az oxálsav kétbázisú sav lévén,
számos sót alkot, amelyeket oxalátoknak neveznek. Ezek közül fontosabbak:
- 1. kálium-oxalát (K2C2O4.H2O), amely az oxálsav és a kálium-karbonát telítése, és az oldatnak kikristályosítása útján készül. Vízben könnyen oldódik. Ezt a sót a barnakő meghatározására és a fotográfozásnál használták. Oxálsavval elegyítve savanyú sóvá, kálium-hidrooxaláttá (KHC2O4.H2O) alakul, mely a természetben számos savanyú ízű növény (például sóska) nedvében megtalálható és legegyszerűbben úgy készül, hogy az oxálsav felét kálium-karbonáttal telítik és a másik felét hozzáöntve kikristályosítják.
- 2. Kálium-quadrioxalát [KH3(C2O4)1.2H3O], amely fő alkatrészét képezi a kereskedésben található u.n. sóskasónak és amelyet a háztartásban tinta- és rozsdafoltok eltávolítására használnak. A kálium-oxalátokhoz teljesen hasonlók a megfelelő nátrium- és ammóniumsók.
- 3. Kalcium-oxalát (CaC2O4.H2O), fehér, por alakú csapadék alakjában válik le, ha a vízben oldható oxalátokhoz kalcium-klorid oldatot öntünk. Megtalálható a növényi és az állati szervezetben (vizeletben), a húgykövekben stb. Vízben és ecetsavban oldhatatlan, de sósavban v. salétromsavban igen könnyen feloldódik. Erősebb hevítéskor kalcium-karbonátra és széndioxidra bomlik. A súly szerinti elemzésben rendszerint e só alakjában választják le a kalciumot. A kalcium-oxaláthoz teljesen hasonló a bárium- és stroncium-oxalát.
- 4. Ferrooxalát (FeC2O4.2H3O), citromsárga csapadék, mely ferroszulfát- és kálium-oxalát oldatok elegyítésekor képződik. A ferrooxalátnak a kálium-oxaláttal való kettős sóját [K2Fe(C2O4)1.2H2O] kiváló redukáló hatásánál fogva a fotográfiában mint igen jó «előhívót» használják.
- 5. Ferrioxalát [Fe1(C2O4)3], frissen készült ferrihidroxidnak oxálsavban való oldása útján kapható. A fény a ferrioxalátot ferrooxaláttá redukálja, ezért az előállításnak sötétben kell történni. Hasonló összetételűek a kromo- és kromioxalátok, amelyek igen szép színűek. Az oxálsavban a hidrogénatomok különféle alkoholgyökökkel (metil, etil stb.) helyettesíthetők és ekkor az oxálsavnak különféle összetett éterei keletkeznek, amelyek azonban csak tudományos érdekűek. Hasonlóképp nem bírnak gyakorlati fontossággal az oxálsav különféle amidjai és más bonyolultabb összetételű vegyületei.
Előállítása:
Nagyban való előállítása úgy
történik, hogy fűrészport kálium- és nátrium-hidroxid elegyével összekeverve,
vas üstökben 200-220 °C-ra hevítik, amikor nátrium- és kálium-oxalát
képződik. A megolvadt barna tömeget vízzel kivonják, és oltott mésszel főzik;
ekkor kalcium-oxalát válik ki, amelyet kénsavval bontanak el, és a megszűrt
oldatból kikristályosítják. Kicsiben legcélszerűbben úgy készíthető, hogy 1
rész cukrot 5 r. salétromsavval (fs. 1,245) főzünk, és a folyadékot
kikristályosítjuk. A kereskedelemben előforduló oxálsav rendszerint nem tiszta,
de igen könnyen megtisztítható úgy, hogy vízben oldjuk, és az oldatot besűrítés
után lassan kihűlni hagyjuk.
Citromsav
A citromsav (oxi-trikarbalilsav) három bázisú szerves sav. Képlete: C3H4(OH)(COOH)3 vagy C6H8O7.
Előállítása:
E savat kristályos állapotban Scheele állította először elő 1784-ben, azonban a borkősavtól már 1776-ban Retzius megkülönböztette. A citromsav
szabad állapotban vagy kálium, illetőleg kalcium só alakjában számos savanyú gyümölcsben előfordul, többnyire kevés borkősav és almasav társaságában. Szabad citromsav
van a ribizkében, egresben, vörösberkenyében, cseresznyében, málnában, szamócában, szederben, tamarindában; különösen a citrom különféle fajtái bővelkednek benne. Kálium és kalcium sóját
számos növény levelében, kérgében és
gyökerében találták. Előállítására a félig érett citrom levét használják, amely
6-7% szabad citromsavat tartalmaz. A citrom levét termelési helyén (Olaszország, Szicília, Spanyolország) nem igen dolgozzák fel, hanem besűrített állapotban bocsátják
kereskedésbe; a citromsavat belőle Német-, Angol- és Franciaországban készítik. A citrom levét előbb tojásfehérjével derítik, azután
kalcium-karbonáttal és kalcium-hidroxiddal telítik. A forraláskor a különben hideg vízben oldható
kalcium-citrát dús fehér csapadék alakjában leválik. A csapadékot még azon
forrón a folyadéktól elválasztják, forró vízzel kimossák és centrifugális
gépekben
megszikkasztják. Az így kapott kalcium-citrátot azután alkalmas keverőgépekben, amelyek ólommal vannak bevonva, híg kénsavval melegen elbontják. Az oldhatatlan kalcium-szulfátról leszűrt citromsav oldatot eleinte szabad
tűzön, utóbb vákuum-készülékekben erősen besűrítik és kikristályosodó, még
tisztátalan citromsavat vízből újból átkristályosítva megtisztítják. A
citromsavat összetevés (szintézis) útján is előállították, úgy hogy szerkezeti
képlete biztonsággal ismeretes. A citromsav vízből kristályosítva színtelen, átlátszó
rombuszos prizmákból áll, melyek fajsúlya 1,617 és 1 mol kristályvizet
tartalmaznak.
Jellemzői:
Enyhe melegen kristályvizéből
veszít, 100 °C-on teljesen vízmentessé válik. A kristályos
citromsav 100 °C-on megolvad, a kristály vízmentes 155 °C körül. Vízben igen könnyen oldódik (3/4
súlyrészben); oldata kellemes savanyú ízű és savanyú kémhatású. Borszeszben is igen könnyen oldódik (1
súlyrész 90%-ban), éterben kevéssé. Hevítéskor bomlik; így
170 °C-ra felhevítve, vízvesztés folytán akonitsav keletkezik; még magasabb
hőmérsékleten szén-dioxid távozik, itakonsav, citrakonsav és ezeknek anhidridjei keletkeznek. Tömény kénsav hidegen színtelenül oldja; de felmelegítéskor az oldat megbarnul.
Salétromsav melegen oldja, ilyenkor sóskasav és ecetsav keletkezik. Vizes oldata könnyen
megpenészedik. Reakciói: ólom-acetát oldattól fehér csapadék (ólom-citrát [Pb3(C6H5O7)2·H2O]
keletkezik, mely ammóniában és alkáli citrátokban könnyen feloldódik. A
citromsav vizes oldata mészvízzel túltelítve átlátszó marad, mert
a képződő kalcium-citrát hideg vízben oldódik, de a folyadékot felforralva,
fehér csapadék keletkezik, mely hosszabb ideig tartó forralás után kristályossá
válik. E csapadék a forró vízben nehezen oldható kalcium-citrát [Ca3(C6H5O7)·24H2O].
Hirtelen felhevítve megszenesedés közben szúrós szagot terjeszt, amely azonban
a borkősav égetett cukorhoz hasonló szagától feltűnően
különbözik.
A citrátok családja:
A citrátok igen különbözőek
lehetnek, például a nátrium-citrát egy citrátsó, míg a trimetil-citrát egy észter. Elsősorban alkálifémekkel (lítium,
nátrium, kálium) alkáliföldfémekkel (magnézium, kalcium) alkot vegyületeket, de léteznek
például a koffeinnel, valamint egyes esetekben fémekkel (ammónium-vas-citrát) alkotott
vegyületei is.
Más citrát-ionok :
Mivel a citromsav három protont
képes leadni, léteznek ún. köztes ionok, amikor csak egyszeres (dihidrogén-citrát H2C6H5O7‒), vagy kétszeres (hidrogén-citrát HC6H5O72‒) negatív töltésű ion keletkezik. Ezek ugyanazokkal az anyagokkal
alkothatnak vegyületet, mint a háromszoros negatív töltésű citrát.
Sói:
A citromsav hárombázisú sav, így tehát háromféle sója, két savanyú és egy bázisos lehetséges:
Egyes fémek (Cu,
Pb) még a hidroxil (OH) csoport hidrogénjét is helyettesíthetik, de az így keletkező vegyületek nem valódi sók, hanem részben alkoholátok is. Az alkálifémek citrátjai vízben igen könnyen oldódnak és más citrátokkal kettős sókat képeznek.
Különösen az ammónium-citrát a kalcium- és vasfoszfátot könnyen oldja, a szuperfoszfátok
és a Thomas-salak foszforsav-tartalmának meghatározásakor használják (citrát módszer).
A magnézium-citrát Mg3(C6H5O7)2·14H2O,
fehér kristályos por, mely vízben igen könnyen oldódik. Vizes oldata nem
kellemetlen ízű és mégis olyan hatásos hashajtó szer, mint a keserűsó
(magnéziumszulfát). A hashajtó limonádé ható alkatrésze.
A ferricitrát Fe2(C6H5O7)2·6H2O,
vörösbarna amorf lemezkékből áll; vízben oldható. Gyógyszerül használják olyan
esetekben, amikor vaskészítmények szedése javallott; úgyszintén kettős sóit is,
így a ferriammónium-citrátot és a ferripirofoszfát-ammóniumcitrátot.
Élelmiszeripari felhasználása:
Élelmiszerekben elsősorban antioxidánsként (bár önállóan nincs ilyen hatása, elősegíti
a többi antioxidáns hatását), savanyúságot-szabályozó anyagként, valamint
ízesítőszerként alkalmazzák E330 néven. Gyümölcsételek esetén késlelteti a gyümölcsök oxigén hatására történő elszíneződését. Napi maximum beviteli mennyisége
nincs korlátozva.[2]
A hiedelemmel ellentétben
semmiféle rákkeltő hatása sincs. A szervezetben
természetes úton előfordul, ráadásul a DNS-hez közel, nagy koncentrációban található,
így ha rákkeltő hatása lenne, szinte az összes sejtünk ráksejtté alakulna. Mi több, ez az egyik legveszélytelenebb
élelmiszeripari adalékanyag. Egyszerre akár 100 gramm is elfogyasztható belőle,
bár az íze ilyen mennyiségben nem túl kellemes. A félreértés valószínűleg onnan
ered, hogy fő eleme a citromsav-ciklusnak, amit más néven Krebs-ciklusnak (Hans
Adolf Krebs fedezte fel
az 1930-as években) is szoktak nevezni. Szerencsétlen módon a rák neve németül
krebs, vagyis egy téves fordítás során Szentgyörgyi-Krebs-ciklus =
rák-ciklus. Ebből következtetve a fordító (hibásan) igen rákkeltő hatást
tulajdonított a citromsavnak.[3]
Háztartási felhasználása:
A citromsav kiválóan alkalmas
háztartási készülékek (kávé- és teafőzők, egyéb kisgépek) vízkőtelenítésére.
Ellentétben az ilyen célra a kereskedelemben kapható szerekkel, nem mérgező,
könnyen elöblíthető, és közönséges élelmiszerboltban vagy gyógyszertárakban az
előbbiek árának töredékéért beszerezhető. A hasonló célra használt ecetnél is sokkal alkalmasabb, mert az utóbbi íze és szaga hosszan
megmarad a kitisztított készülékekben.
Ecetsav
Az ecetsav, más néven etánsav,
egy szerves vegyület, melynek képlete: CH3COOH. Könnyen felismerhető
arról, hogy ez adja az ecet savanyú ízét és átható szagát.
A tiszta, vízmentes ecetsav (a jégecet) színtelen folyadék, amely vizet
köt meg a környezetéből (higroszkópos), 16,7 °C alatt megfagy és színtelen kristályt képez. Az ecetsav korrozív
és gőzei ingerlik a szemet, az orr- és a toroknyálkahártyát, a tüdőt annak
ellenére, hogy vizes oldatban kevésbé disszociál, mivel gyenge sav.
Az ecetsav az egyik legegyszerűbb karbonsav (a második legegyszerűbb a hangyasav után).
Fontos kémiai reagens és ipari nyersanyag. Főként a polietilén-tereftalát
(szénsavas italok palackjai), cellulóz-acetát (fényképészeti film), polivinil-acetát (ragasztó) valamint műszálak és
szövetek gyártásában használják.
A háztartásban főként vízkőoldónak használják, (valamint főzésre a híg ecetet).
Az élelmiszeriparban az ecetsavat E260-nal jelölik és savanyúság szabályozására használják. A világ
ecetsavigénye mintegy 6,5 millió tonna/év (Mt/a), ebből kb. 1,5 Mt/a újrahasznosításból származik. A
többit a kőolajipar állítja elő, illetve biológiai forrásokból nyerik.
Nevezéktan:
A triviális ecetsav elnevezést
igen széles körben használják, és a IUPAC is támogatja. A név az ecet latin
megfelelőjéből, az acetum szóból származik. Az etánsav a vegyület
szisztematikus neve, mellyel főleg a kémiai nevezéktan alapjait ismertető
leírásokban találkozhatunk.
A jégecet név a vízmentes ecetsav
hétköznapi elnevezése. A német névhez (Eisessig) (szó szerinti fordításban,
jég-ecet) hasonlóan, az elnevezés a kevéssel szobahőmérséklet alatt,
16,7 °C-on kialakuló jégszerű kristályokra utal.
A leggyakoribb, hivatalosan is
elfogadott rövidítés az AcOH vagy HOAc jelölés, ahol az Ac az acetil-csoportot
CH3−C(=O)− jelöli. Sav-bázis reakciók leírásakor gyakran
előfordul a HAc jelölés, ahol a korábbiaktól eltérően az Ac az acetát anion (CH3COO-)
jelölése. Ezt a jelölésmódot azonban sokan félrevezetőnek tartják. Az Ac jelet
semmi esetre sem szabad összekeverni az aktínium nevű elem vegyjelével.
Az ecetsav tapasztalati képlete CH2O, összegképlete C2H4O2.
Utóbbit gyakran írják a szerkezetet jobban tükröző CH3-COOH, CH3COOH,
vagy CH3CO2H formában. Az ecetsavból H+ ion
elvesztésével keletkező ion az acetát anion. Az acetát név utalhat még acetát
iont tartalmazó sókra vagy az ecetsav észtereire.
Történet:
Az ecet egyidős az emberi civilizációval, talán még idősebb is annál.
Ecetsavtermelő baktériumok a világon mindenütt előfordulnak és minden kultúra,
ahol ismerték a sör vagy a bor készítést, elkerülhetetlenül felfedezte az
ecetet, mint annak következményét, ha ezeket az alkoholos italokat hosszasan
levegővel érintkezni hagyták.
Az ecetsav kémiai felhasználása
igen messzire nyúlik vissza. Az ie. 3. században Theophrasztosz görög filozófus leírta, hogy ecet és különböző fémek
kölcsönhatásával hogy lehet a művészek számára értékes színezőanyagokat
előállítani. Ilyen volt az ólomfehér (ólom-karbonát) és a verdigris, egy rézsókat,
többek között réz(II)-acetátot tartalmazó zöld festék. Az ókori rómaiak a
megecetesedett bort ólomedényekben forralták, hogy az igen édes, sapa-nak
nevezett sziruphoz jussanak.A sapa sok ólom-acetátot tartalmazott, amit édes íze miatt ólomcukornak illetve
Szaturnusz-cukornak is neveznek. Ez feltehetően hozzájárult a római
arisztokrácia körében előforduló ólommérgezésekhez.
A 8. században Jabir Ibn Hayyan
(Geber) perzsa alkimista ecet desztillálásával tömény ecetsavat állított elő. A
reneszánsz idején az ecetsavat fém-acetátokból állították elő száraz
desztillációval. A 16. században Andreas
Libavius német
alkimista írt le egy ilyen eljárást és az így nyert jégecetet összehasonlította
a közönséges ételecettel. Az ételecetben lévő víz azonban olyan mértékben
változtatja meg az ecetsav tulajdonságait, hogy sok vegyész évszázadokon át úgy
hitte, az ételecetben talált sav és a jégecetet alkotó sav két különböző
vegyület. Pierre Adet francia vegyész bizonyította be, hogy a két anyag azonos.
1847-ben Hermann Kolbe német kémikus első ízben állított elő ecetsavat
szervetlen vegyületekből. Az eljárás során szén-diszulfidból klórozással
szén-tetrakloridot állított elő, melyből pirolízissel tetraklór-etilént nyert. Ezt a vegyületet vizes
klórozással triklórecetsavvá alakította, amiből elektrolitikus redukcióval
jutott az ecetsavhoz. 1910-re a jégecet legfontosabb forrása a fa száraz lepárlásakor keletkező „faszesz” lett. Az ecetsav
elkülönítésére mésztejet adtak hozzá, majd a keletkező kalcium-acetátból kénsavval szabadították fel.
Ebben az időben Németország évi 10 000 tonna jégecetet állított elő,
melynek közel 30%-át az indigó nevű színezék előállítására használták.
Kémiai tulajdonságok:
Savasság
Az ecetsav és a többi karbonsav
karboxil-csoportjában (-COOH) található hidrogén (H) H+ ion (proton)
formájában lehasadhat, ami savas jelleget ad a vegyületeknek. Az ecetsav vízzel
szemben gyenge, egyértékű savként viselkedik, pKa = 4,8 értékkel.
Konjugált bázispárja az acetát ion (CH3COO-). 1,0 mólos
(M) oldatának (ez közelítőleg a háztartási ecet töménységének felel meg) pH-ja 2,4, ami azt jelenti, hogy az
ecetsavmolekuláknak mindössze 0,4%-a található disszociált állapotban.
Ciklikus
dimer
Az ecetsav kristályszerkezetének
vizsgálata azt mutatta, hogy a molekulák dimerekké állnak össze, melyeket
hidrogénkötések tartanak össze. Ezek a dimerek az ecetsav gőzeiben is
kimutathatóak 120 °C-on. Folyadékfázisban is előfordulnak, hidrogénkötések
kialakítására nem képes oldószerrel készült híg ecetsavoldatokban, és bizonyos
mértékben magában a tiszta ecetsavban is. Hidrogénkötések kialakítására képes
oldószerekben azonban szétesik a dimer. A dimer disszociációs entalpiája a
becslések szerint 65,0–66,0 kJ/mol, disszociációs entrópiája 154–157 J mol−1
K−1. Ez a dimerizációs hajlam más kisméretű karbonsavakra is
jellemző.
Az
ecetsav mint oldószer
A folyékony ecetsav hidrofil
(poláris), protikus oldószer, az etanolhoz és a vízhez hasonlóan. Közepes
dielektromos állandójával nem csak a poláris anyagok, mint a szervetlen sók és
cukrok, de az apoláris vegyületek, például olajok illetve egyes elemek: a kén és jód oldószere is lehet. Készségesen elegyedik
számos poláris és nem poláris oldószerrel, mint például a vízzel, kloroformmal, hexánnal. Oldóképessége és elegyedési
hajlama miatt fontos ipari vegyszer.
Kémiai
reakciók
Az ecetsav számos fémet megtámad,
többek között a vasat, magnéziumot és cinket, melyekkel hidrogén fejlődése mellett fém-acetát sókat képez. Az
alumínium felületén, oxigénnel érintkezve vékony alumínium-oxid réteg képződik, amely ellenáll az ecetsavnak, így az ecetsav
alumíniumból készült tartályokban szállítható. A fém-acetátok ecetsavból is
előállíthatóak megfelelő bázis segítségével, mint ahogyan az a “sütőpor +
ételecet” kölcsönhatásból közismert. Szinte minden acetát jól oldódik vízben.
Érdekes kivételt jelent a króm(II)-acetát.
Mg(s) + 2 CH3COOH(aq) → (CH3COO)2Mg(aq) + H2(g)
NaHCO3(s) + CH3COOH(aq) → CH3COONa(aq) + CO2(g) + H2O(f)
Az ecetsav adja a karbonsavak
jellemző kémiai reakciói, például lúgokkal a megfelelő acetátsót képezi.
Karbonátokkal és hidrogénkarbonátokkal szén-dioxid és víz keletkezése mellett
úgyszintén fém-acetátokat alkot. Reakciói közül az egyik legfontosabb az
ecetsav etanollá történő redukciója. Fontos sajátsága az ecetsavnak, hogy nukleofil szubsztitúcióval olyan származékok nyerhetők
belőle, mint az acetil-klorid. A két savmolekulából
vízkilépéssel keletkező ecetsav-anhidrid is egy fontos vegyület. Az ecetsavból észterek állíthatóak elő Fischer észteresítéssel, illetve amidok is
nyerhetőek belőle. 440 °C fölé hevítve az ecetsav szén-dioxidra és
metánra, illetve keténre és vízre bomlik.
Kimutatása
Az ecetsav felismerhető szúrós
szagáról. Az acetátok jellemző színreakciót adnak vas(III)-klorid oldattal, az
oldat mélyvörös színű lesz, de savanyítás hatására elszíntelenedik. Arzén-trioxiddal hevítve az acetátok kellemetlen, jellegzetes
szagú kakodil-oxid keletkezése közben reagálnak.
Gyártása:
Gyártható mesterségesen más
anyagokból, de készülhet erjesztéssel is. Habár az erjesztássel készült ecet
csak a világtermelés kb. 10%-a, bizonyos országokban a törvények kikötik, hogy
étkezési célra csak természetes eredetű ecet használatnak. Nagyjából 75%-a
metanolból és szén-dioxidból készül.
Metanol
karbonilezése
A gyártás során metanolból és
szén-monoxidból ecetsav keletkezik a következő egyenlet szerint:
CH3OH + CO → CH3COOH
A háromlépéses folyamatban jódmetán is keletkezik. Katalizátorként
általában valamilyen fém-komplexet használnak.
- CH3OH + HI → CH3I + H2O
- CH3I + CO → CH3COI
- CH3COI + H2O → CH3COOH + HI
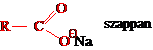
Szappanok
A szappan a legősibb
mosószer. Kémiai meghatározással a szappan karbonsavak nátriumsója. A karbonsav nagyobb szénatom
számú kell, hogy legyen.
A zsírsavak közül a hosszú szénláncú szerves savaknak (elsősorban a palmitin-,
a sztearin-, az olaj- és a laurinsavnak), a fémek közül pedig a nátriumnak és a
káliumnak van fontos szerepe. A nátronszappan szilárd, a káliszappan kenőcsős
állagú.
A zsírok és az olajok hidrolízisének
Lúgos közegben az észterek hidrolízist szenvednek. Ennek megfelelően ilyen
körülmények között a zsírok és az olajok is hidrolizálnak, és glicerin és a
megfelelő zsírsavak sói képződnek.
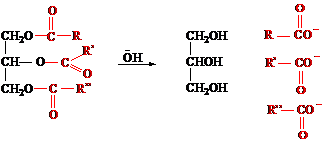
Mivel a zsírsavak sóit szappanoknak hívják, a zsírok lúgos hidrolízisét elszappanosításnak is nevezik. A szappanok kettős típusú vegyületek. Poláris jellegű ionos részük poláris oldószerekben (például vízben) oldódik, a hosszú alkillánc viszont apoláris oldószerekben lenne képes oldódni.
A két ellentétes hatás miatt a szappanok egyszerre képesek poláris és apoláris molekulákhoz is kapcsolódni. A szappanok Ca- és Mg-sói vízben oldhatatlanok, ezért kemény vízben kicsapódnak. A szintetikus detergensek (például az alkilbenzolszulfonsavak sói) viszont nem csapódnak ki kemény vízben sem.

Az ősi szappangyártás:
A házilag készült szappant a
következő technológiai lépésekben gyártották. Zsíros és faggyús állati
anyagokat (például a disznóvágásból kimaradtakat) NaOH-val (nátrium-hidroxid, lúgkő) együtt
főzték, melynek során glicerin és a karbonsavak nátriumsója
keletkezett. Mivel a glicerin és az említett só még összekevert állapotban
volt, az oldatba konyhasót adagoltak és ennek hatására a szappan kivált az
oldatból.
A mosás folyamata és a szappan szerepe:
A mosáshoz olyan felület-aktív
anyagot kell vízben oldanunk, aminek a működését a molekula szerkezete alapján
érthetjük meg. A karbonsav-szénlánc végén található a nátrium. A karbonsav
láncvég a zsírokban, a nátrium a vízben oldódik jól. Ezért a ruhán lévő zsíros
szennyeződésre a szappanmolekulának a karbonsav szénláncú vége tapad (oldódik
benne), míg a nátrium víz irányában helyezkedik el. Sok-sok ilyen szappanmolekula
körbefogja a szennyeződést, a nátriumvégződések pedig, a víz irányba rendeződve
biztosítják, hogy az így létrejött nagymolekula a vízben mozoghasson, a
felületről eltávolodhasson.




