4.tétel
Az anyagi halmazok
szerkezete, a halmazok állapota, a kristályos szerkezet fajtái
A nagyon sok részecskéből felépülő anyagi rendszereket
halmazoknak nevezzük. A halmazokat alkotó részecskék lehetnek atomok, ionok,
molekulák.
A legtöbb kémiai anyag – a hőmérséklettől és a nyomástól függően – három,
klasszikusan értelmezett halmazállapotban
lehet stabilis állapotú: légnemű,
folyékony és szilárd. Elméletileg minden anyag
mindhárom halmazállapotban előfordulhat, a gyakorlatban viszont sok szilárd
anyag elbomlik, vagy átalakul az olvadáspontjánál
kisebb hőmérsékleten, azaz inkongruens olvadáspontja van. Ugyanilyen okok miatt
sok anyagnak nem létezik légnemű halmazállapota, vagyis már a forráspontjánál
kisebb hőmérsékleten termikusan elbomlik. A fenti három halmazállapoton kívül
létezik az anyagok negyedik halmazállapota is, amely már a 20. század
közepén fontossá vált: ez a plazmaállapot.
Szilárd halmazállapot:
A szilárd halmazállapotnak két formája ismeretes: kristályos (pl: gyémánt, jég, NaCl, Cu) és alaktalan
vagy amorf (pl: zsír, viasz, kaucsuk). Ebben az állapotban a molekulák
ill. az atomok energiaszintje olyan alacsony, hogy adott helyzetükből nem
tudnak kiszabadulni. Kristályos anyag esetén azok a kristályrács által
meghatározott egyensúlyi helyzetben vannak rögzítve, és ekörül végeznek
rezgőmozgást. Szilárd anyagoknak (vagy testeknek)
meghatározott alakjuk és térfogatuk van, de a térfogat általában a hőmérséklet emelésével kiterjed. A
kiterjedés mértékét a hőtágulási együttható fejezi ki, ami az anyagok
jellemző tulajdonsága. A szilárd anyagok ellenállást fejtenek ki az alak- és
térfogat-változtatással szemben, ennek megfelelően több tulajdonságuk összefügg
ezzel az ellenállással: keménység, szilárdság, rugalmasság, hőtágulás. Melegítés hatására általában csökken a szilárdságuk és az olvadáspontjukon (általánosabban a likvidusz hőmérsékleten) folyékonnyá válnak.
Folyékony halmazállapot:
A folyékony anyagok, vagyis folyadékok
térfogata állandó, ám alakja változó. A nehézségi erő hatására képesek felvenni
a tároló edény alakját. Erőtérmentes környezetben viszont gömb alakúak a felületi feszültség következtében. A folyadékokban a molekulák közötti összetartó erő lényegesen kisebb mint a
szilárd anyagoknál, és noha az anyaghalmazt összetartja, de lehetővé teszi a
molekulák egymáshoz képest történő makroszkopikus, szabad mozgását. Ennek
következtében a viszkozitásuk a szilárd testek viszkozitásához
képest kicsi, de az összenyomhatóságuk (kompresszibilitásuk) azokhoz közel
állóan kicsi.
Az anyag felületi feszültsége a kritikus hőmérsékletéhez közeledve nullára csökken, azt
elérve, illetve nagyobb hőmérsékleten a folyadék gázzá változik. Zárt térben a folyadékok sűrűsége csökken a légtérben pedig növekszik. A kritikus hőmérsékleten a
két fázis sűrűsége egyenlővé válik. Az anyagok a kritikus hőmérséklet alatt gőz, a felett gáz halmazállapotúak. A kritikus hőmérsékletnél
nagyobb hőmérsékleten a légnemű anyag semmilyen nagy nyomáson sem
cseppfolyósítható, mert ilyen körülmények között már nem gőzként, hanem gázként
viselkedik.
Légnemű halmazállapot:
A légnemű anyagoknak nincs sem meghatározott alakjuk, sem
meghatározott térfogatuk, a rendelkezésre álló térfogat egyenletes kitöltésére
törekszenek. Az elemi állapotú anyagok nagy többsége légnemű állapotban – tehát
gőz és gáz állapotban – színtelenek, aminek az az oka,
hogy a látható színképtartományban nincs fényabszorpció. Ez alól kivételt a kén
és a halogén elemek gőzei képeznek.
A reális gázok esetében a molekulák
között viszonylag kicsi az összetartó erő, a forgó, rezgő és az egyenes vonalú,
egyenletes mozgás miatt egymással ütköznek és távolodni igyekszenek egymástól,
ezért töltenek be minden rendelkezésre álló teret. Ez csak akkor igaz, ha a
gázra nem hatnak külső erők. A földi nehézségi erőtér hatására például a légkör
sűrűsége felfelé exponenciális függvény szerint csökken. Kis
magasságkülönbség esetén azonban az eltérés figyelmen kívül hagyható.
A légnemű anyagok alakja és
térfogata viszonylag kis erővel megváltoztatható, mert kicsi a viszkozitásuk, és nagy a kompresszibilitásuk a folyadékokéhoz, vagy a szilárd
testekéhez képest.
Plazma halmazállapot:
Plazma a gáz-halmazállapotból
keletkezik az atomok ill. molekulák ionizációja révén. Nagyon nagy
hőmérsékleten, sugárzás vagy elektromos kisülés hatására az atomokból elektronok szakadnak le. A plazma állapotban szabadon mozgó pozitív ionok és negatív elektronok vannak olyan arányban, hogy az egész rendszer elektromosan
semleges. A szabadon mozgó részecskék miatt a plazma jól vezeti az elektromos áramot.
Kellően nagy hőmérsékleten minden
anyag átvihető plazmaállapotba (termikus ionizáció), legkönnyebben az alkálifémek gázai. Teljes ionizációhoz – a hideg plazma kialakulásához – sok
tízezer fokos hőmérséklet szükséges, a forró plazma hőmérséklete több millió
fokos. A világegyetem látható anyagának 99%-a (csillagok, csillagközi és bolygóközi anyag) plazma állapotban van.
Földi viszonyok között plazma
képződik például a villámban, elektromos szikrában, koronakisülésben, elektromos
ívben, gázkisülési csövekben stb.
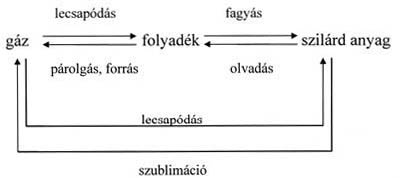
Halmazállapot-változás:
Az anyagok hőmérsékletének
valamint nyomásának bizonyos fokú változása halmazállapot-változást idéz elő.
Ez a változás mindig visszafordítható (reverzibilis) folyamat, ha közben
termikus bomlási folyamat nem megy végbe.
A halmazállapot-változást
melegítés során például akkor következik be, ha a hőmérsékletnövelés olyan
mértékű rezgőmozgásra készteti az atomokat, melyet a kohéziós erők nem tudnak
kompenzálni, így az atomok az előző állapotához képest szabadabbá válnak. Első
lépésben a rácsponti kötőerők szűnnek meg, (szilárd-folyadék fázisátalakulás), majd azok a kohéziós erők,
amelyek a folyadék részecskéi között működnek (folyadék-gőz fázisátmenet), végül pedig az atomokon belüli elektrosztatikus
vonzóerők ellenére az elektronok egy része vagy teljes mennyisége
leszakad az atommagról (gáz-plazma fázisátmenet).
Avogadro törvénye:
Az ideális gázokban a részecskék közötti kölcsönhatás
elhanyagolható, ezért érvényes rájuk Avogadro
törvénye. Ez kimondja, hogy az
azonos térfogatú, azonos hőmérsékletű és nyomású gázok azonos számú részecskét
tartalmaznak.
A gázok azonos számú molekulája
azonos hőmérsékleten és azonos nyomáson egyenlő térfogatot tölt be és ez a
térfogat standard körülmények között (25°C) 0,1 MPa nyomáson 24,5 dm3.
A gázok moláris térfogata megadja 1 mol gáz térfogatát jele: Vm =
V/n (dm3/mol)
Az anyagok kristályos és amorf szerkezete:
Az ásványok alaktani és fizikai
tulajdonságaik alapján kétfélék lehetnek.
- Alaktalanok vagyis amorfok, melyeknek semmiféle jellegzetes
alakjuk nincs és fizikai
tulajdonságaik minden irányban megegyeznek,
ezek izotrópok. (pl: faopál)
- Kristályosak, (pl: Ametiszt)amelyeknek valamilyen törvényszerű,
illetve szimmetrikus alakjuk van, és fizikai
sajátosságaik csak a párhuzamos
irányokban azonosak, a különböző irányokban általában
eltérőek, ezek anizotrópok.
Az ásványok zöme anizotróp,
vagyis jellemzőjük a kristályszerkezet,
az alkotóelemek térbeli elhelyezkedése, vagyis az a kristályrács, ami különböző
szimmetriákban nyilvánul meg, és egyes ásványfajtákon belül különböző is lehet.
A kristályrácsok típusai:
A kristályrácsot atomok, ionok,
és molekulák is alkothatják. A rácspontokon elhelyezkedő kristályrácsalkotók
közötti kötés jellege szerint négy különböző kristályrácstípust ismerünk:
atom-, ion-, molekula- és fémrácsot. A kristályrács fölépítése során a rácspontba
beépülő elemek energiát adnak le, ezért a kristályrács fölbomlásához
energiabefektetés szükséges.
|
|
IONRÁCS |
ATOMRÁCS |
FÉMRÁCS |
MOLEKULARÁCS |
|
Részecskék
a rácspontokon: |
ellentétes
töltésű ionok |
atomtörzsek |
atomtörzsek |
molekulák |
|
Rácsösszetartó
erő: |
elektrosztatikus
vonzóerő (ionkötés) |
kovalens
kötés |
delokalizált
elektronok |
másodrendű
kötőerők (dipólus –
dipólus kölcsönhatás, diszperziós kölcsönhatás, hidrogénkötés) |
|
Olvadás-
és forráspont: |
magas / a
nagy rácsenergia miatt/ |
magas
/erős kovalens kötések miatt/ |
változó
/változó erősségű fémes kötés miatt/ |
alacsony /
gyenge másodrendű kötések/ |
|
Halmazállapot
/szobahőmérsékleten/ |
szilárd |
szilárd |
szilárd /a
higany kivételével/ |
lehet gáz,
folyadék, szilárd |
|
Keménység: |
viszonylag
nagy |
nagy |
változó |
kicsi |
|
Vezetőképesség: |
szilárd:
szigetelő |
szigetelő
vagy félvezető |
jó vezető |
szigetelő |
|
Oldhatóság: |
vízben
általában jól |
- |
- |
polaritástól
függ |
|
Példák az
elemek közül: |
NINCS! |
B, C, Si, Ge |
kis EN-ú
elemek /fémek/ |
a nagy
EN-ú elemek /nemfémek/ |
|
Példák a
vegyületek közül. |
kis EN-ú
fémek és a nagy EN-ú nemfémek vegyületei /NaCl, CaO/ |
B2O3, SiO2 |
néhány
szulfid |
nemfém
vegyületek, /szárazjég/, szerves vegyületek |