9. tétel
A természetes szenek allotrópjainak kristályszerkezete, a szén oxidjai
Szén (C)
A szén a
periódusos rendszer egy kémiai eleme. Vegyjele C,
rendszáma 6. A IV. főcsoportba, a nemfémek közé tartozik.
Négy vegyértékű, a természetben nagy mennyiségben előforduló elem. Több
allotróp módosulata is létezik: legjelentősebbek a grafit, a gyémánt és a fullerének.
- A gyémánt a legkeményebb ismert ásvány. Az sp3-hibridizáció során négy, egyenértékű sp3
hibridpálya jön létre, úgy, hogy a szénatom egy szabályos tetraéder
középpontjában helyezkedik el és a kötések a tetraéder csúcsai felé
mutatnak. A tetraéderes elrendeződés miatt a létrejövő molekulák nagy
stabilitásúak. Széles tiltott sávú félvezető. Nagy a fénytörése, és ha idegen anyagokkal érintkezik megváltozhat a
színe. Áramot nem vezet.
- A grafit egyike a legpuhább anyagoknak. Lágy és könnyen hasad, a papíron
nyomot hagy. A hőt és elektromosságot jól vezeti. Az sp2-hibridizáció
során csak három elektron vesz részt a kötések kialakulásában, ezek három,
ugyanabban a síkban, egymástól 120°-ra elhelyezkedő kötést eredményeznek,
míg a negyedik elektron a síkra merőleges pályán helyezkedik el. A három
egymással 120° szöget bezáró kötés eredményezi a grafit, hatszöges
rétegekből felépülő, „méhsejt-szerű” atomi elrendeződését.
- A fullerének nanométer nagyságrendű molekulák.
Legegyszerűbb formájában 60 szénatom grafitréteget alkot, ami 3
dimenzióban meg van hajlítva, futball-labda alakra. A térfogatuk 70%-ra
összenyomva szilárdságuk a gyémántét is meghaladja. Különféle körülmények
között alkalmas hőszigetelésre, félvezetésre vagy szupravezetésre.
Az állati szén
apró grafitszerű részekből áll. Ezek véletlenszerűen oszlanak el, a struktúra
egésze tehát izotrópikus.
Az úgynevezett „üveges szén” izotrópikus, és az üveghez hasonló tulajdonságokat
mutat. A grafitrétegek nem úgy rendeződnek benne, mint a sima grafitban, hanem
össze vannak gyűrődve mint egy összegyűrt papíros.
A szénszál az üveges szénre hasonlít. Különleges kezeléssel (a szálak nyújtása
és karbonizációja) a szén síkjait a szál irányába lehet rendezni. A szál
tengelyére merőlegesen egyáltalán nem rendeződnek szénsíkok. Ennek
eredményeként a szénszál szakítószilárdsága az acélénál is nagyobb lehet.
Jellemzői:
A szén több
szempontból is figyelemreméltó elem. Különböző formái között megtalálható az
ember által ismert egyik legpuhább (grafit) és legkeményebb (gyémánt) anyag is.
Ezentúl, könnyen létesít kémiai kötést más kis atomokkal, beleértve más
szénatomokat, kis mérete pedig többszörös kötések kialakítására is alkalmassá
teszi. Ezen tulajdonságai miatt több mint 10 millió különböző vegyületet alkot.
A szénvegyületek a földi élet alapjául szolgálnak, és a szén-nitrogén
ciklus során a Nap és más csillagok
energiatermelésében is részt vesz.
A Nagy Bumm során nem
keletkeztek szénatomok, mivel azok csak alfa-részecskék (hélium atommagok)
hármas ütközése során jöhetnek létre. Az univerzum kezdetben túl gyorsan tágult
és hűlt le ahhoz hogy ez megtörténhessen. Termelődik viszont szén felszálló ágban lévő csillagok belsejében, ahol a három alfás (vagy
Salpeter-) ciklus során a hélium atommag alakul
nagyon rövid időre berilliummá, majd szénné.
A periódusos
rendszer egyetlen elemének, a szénnek ma több ismert vegyülete van, mint az
összes többi elemnek együttvéve. A napjainkig megismert szénvegyületek száma
több, mint 5 millió. Ezt a szénatom különleges tulajdonságai teszik lehetővé.
Az alapállapotú szénatom elektronszerkezete: 1s22s22p2
A szénatom vegyértékelektronjából kettő párosított és kettő párosítatlan. A
párosított elektronok egyike energia felvételével az üres 2p atompályára kerül.
Ezt követően (kötések létesülésekor) az 1 db 2s pálya hibridizálódik
(keveredik, kombinálódik) a 3 db 2p pályával és 4 db egymással egyenértékű
(azonos energiájú) sp3-hibridpálya jön létre. A szénatom
nemesgázszerkezet eléréséhez négy elektront képes felvenni, amit négy kovalens
kötés kialakításával ér el.
Csoportosítása:
A szerves
vegyületek csoportosítására lehetőséget ad a szénlánc alakja. Eszerint
megkülönböztetünk nyílt láncú és zárt láncú (gyűrűs) vegyületeket. az elágazást
nem tartalmazó szénláncot normális szénláncnak nevezzük. a valóságban a láncok
nem egyenesek, hanem "zegzugosak". Ennek az az oka, hogy a szénatomok
a tetraéderes kötésirányok miatt sosem esnek egy egyenesbe. A nyílt láncú
szénvegyületek lehetnek normális vagy elágazó láncúak.
A szénatomok közötti kötések alapján is csoportosíthatjuk a szénvegyületeket.
Azokat s szerves vegyületeket, melyekben a szénatomok csak egyszeres kovalens
kötéssel kapcsolódnak egymáshoz, telített vegyületeknek nevezzük. Azokat a
szénvegyületeket, amelyek molekuláiban vannak olyan szénatompárok, amelyek közt
kétszeres vagy háromszoros kötés is van, telítetlen szénvegyületeknek nevezzük.
(Mindkét csoportban lehetnek nyílt láncú és gyűrűs molekulák is.)
Felhasználása:
A szén minden
ismert élet alapja, enélkül az élet – ahogy mi ismerjük – nem létezhetne. A
gazdaság a szenet főleg mint ásványi szén használja. Elsősorban elektromos
energia elállítására a széntüzelésű erőművekben. De nagy
mennyiségű szén kell a vasolvasztókban, ahol a szén égése a magas hőmérsékletet
szolgáltatja, és egyidejűleg kiredukálja a vasat a vasércből. A világon ma
évente kb. 4.5 milliárd tonna szenet bányásznak (2007). Kényelmes fosszilis
tüzelőanyagok a szénhidrogének (földgáz, nyersolaj). A nyersolajból az olajipar
benzint, gázolajat, kerozint, kenőolajokat stb. állít elő a lepárlóüzemekben. A
nyersolaj képezi az alapját számos szintetikus anyagnak, amiket összefoglalóan műanyagoknak hívunk.
Egyéb
felhasználásai:
- 14C-izotópot (felfedezése: 1940. február 27.) használnak a radiokarbon
kormeghatározásban
- Egyes füstdetektorok kis
mennyiségű radioaktív szénizotópot tartalmaznak ionizáló
sugárzásforrásként. (A legtöbb ilyen detektor amerícium-izotópot használ.)
- a grafitot agyagásványokkal
vegyítve a ceruzabél anyagát kapjuk
- az ékszergyémántot díszítésre
használják
- az ipari gyémánt keménysége
miatt fúró, vágó ill. csiszoló anyag
- szenet adnak a nyersvashoz az acél előállítása során
- grafitot használnak némelyik
típusú atomerőmű (Csernobil) moderátor anyagaként
- az orvosok széntablettát adnak
mérgezések esetén, mert jól megköti a mérgeket
- élelmiszer-adalékként jele E153
A fullerének
kémiai és szerkezeti tulajdonságai ígéretes jövőt jósolnak neki a
nanotechnológiában (szén nanocsövek).
A szén allotróp
módosulatai
A szénnek legalább négy allotróp
alakjáról tudunk: amorf szén, grafit, gyémánt és a fullerének. 2004. március 22-én jelentették be egy ötödik alak
létezését. Az amorf alak lényegében megegyezik a grafittal, de nincsen kristályos makroszerkezete. Ehelyett porszerű anyag,
ami a faszén fő alkotóelemét adja.
Allotrópia:
Az allotrópia lényege, hogy
egyes kémiai
elemek különböző kristályszerkezetű, ill. relatív molekulatömegű ún. allotróp
módosulatokban is előfordulhatnak. Az allotróp átalakulás fázisátalakulás, amely egyes esetekben mindkét
irányba végbemehet, más esetekben csak egy irányban lehetséges. Allotróp
módosulat pl. a gyémánt és a grafit, a vörös és a fehér foszfor, az oxigén (O2)
és az ózon (O3). Az allotróp módosulatok fizikai sajátságai mindig
eltérők, és kémiai tulajdonságaik is különböznek egymástól. E sajátságok oka az
eltérő kristály-, ill. molekulaszerkezet.
Grafit
Normál légköri
nyomáson a szén
grafit alakban létezik, ilyenkor minden atomja három vele egy síkban lévő atomhoz kötődik, és így egymásba
fonódó hatszögű gyűrűket alkotnak, hasonlóan az aromás szénhidrogénekhez. A grafit hexagonális
(alfa-grafit) és romboéderes (béta-grafit) rendszerben kristályosodhat. A természetben található grafit max. 30%-ot
tartalmaz a béta-formából, míg a mesterségesen előállított grafit egyáltalán
nem tartalmaz. Az alfa-grafitból bétát előállítani mechanikai kezeléssel lehet,
a béta-grafit pedig 1000 °C fölé hevítve visszaalakul alfa-grafittá. Delokalizált pi-mezője
miatt a grafit vezeti az elektromosságot. Mivel a grafit puha, és rétegeit csak a van der
Waals-erő tartja
össze, jól hasítható.
Kémiai és fizikai tulajdonságai:
- Képlete: C (szén)
- Szimmetriája: α-grafit hexagonális
(hexagonális holoéderes), α'-grafit trigonális (ditrigonális
szkalenoéderes)
- Sűrűsége: 2,15 g/cm3
- Keménysége: 1 (a Mohs-féle
keménységi skálán)
- Hasadása: kitűnően hasad és könnyen
transzlatálható
- Színe: acélszürke, vasfekete; nem
átlátszó (opak)
- Porszíne: fekete fénylő
- Fénye: fémfényű vagy fénytelen
- Egyéb jellegzetes
tulajdonságai: A gyémánttal ellentétben vezeti az elektromosságot.
- Olvadáspontja: kb. 3700 °C-on
Megjelenési formái:
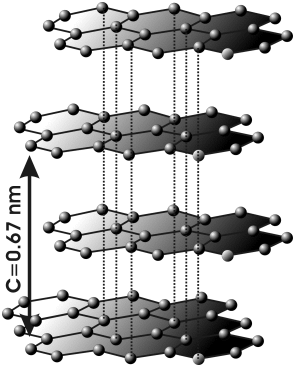
Szerkezete
jellegzetes rétegrács. A hexagonális hálózatú rétegekben az atomok távolsága
(1,42 Ǻ) kisebb, mint a a gyémántrácsban (1,542
Ǻ), míg két szomszédos réteg 3,35 Ǻ (10 Ǻ = 1 nm)
távolságra van egymástól. A rétegsíkokat gyenge van-der-Waals-erők
tartják össze. Fejlett lapokkal határolt, kristályos alakban ritka, többnyire
pikkelyes-leveles vagy vaskos, szemcsés, néha földes halmazokban jelenik meg.
Előfordulása, képződése:
- Metamorf eredet – Metamorfizált kőzetekben
szerves eredetű grafit képződik kőszenes üledékekből, nyomás és
hőmérséklet együttes hatására, de kontakt metamorf hatásra is keletkezik.
- Magmás keletkezés – Gránitpegmatitokban,
gránit-mészkő kontaktusán, valamint hidrotermális képződése is ismert.
- Meteorit ásvány – Főként vas-, de egyes
szilikátmeteoritokban is megtalálható kisebb-nagyobb gumókban.
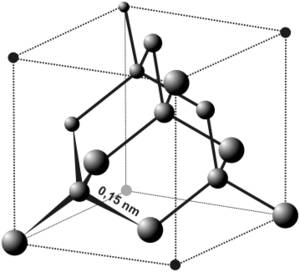
Gyémánt
Igen nagy nyomáson keletkező allotróp szénmódosulat a gyémánt, melyben minden szénatom egy szabályos tetraéder középpontjában helyezkedik el, és a kötések a tetraéder csúcsai
felé mutatnak. A szén-szén kötés ereje miatt a bór-nitriddel együtt a legnagyobb a keménysége az ismert anyagok között. Szobahőmérsékleten észrevehetetlenül lassan a
stabilabb grafit-alakba megy át.
Fizikai és
kémiai tulajdonságai:
A gyémánt rendkívül kemény, rideg.
Színtelen köbös lapcentrált rácsszerkezetű
kristálya,
tetraéderes koordinációjú.
A szénatomok úgy helyezkednek el benne, mintha a metánban a hidrogének helyén is szénatomok lennének és minden egyes szénatom egy újabb tetraéder részét alkotná. A tiszta gyémánt
szintelen kristályokból áll.
Keménysége valamennyi ismert anyag között
az egyik legnagyobb, a csak bór- és bizonyos más karbidok illetve nitridek közelítik meg.
Vezetőképessége kicsi.
1500°C felett spontán grafittá alakul.
Mesterségesen is előállítható gyémánt grafitból igen nagy nyomáson.
A gyémánt sűrűsége feltűnően nagy, mert a szénatom átmérője kicsi.
Ezek a tulajdonságok a szénatomok közötti erős kovelens kötés következményei.
Két szomszédos szénatom távolsága 1,54 Angström, a C - C - C vegyértékszög 109°28' (tetraéderszög). Ez a vegyértékszög jellemző pl. a paraffin szénhidrogénekre.
Felhasználás:
Megfelelő nagyságú példányait ékszerekké csiszolják.
Rendkívüli keménységük miatt csiszolóanyagokhoz, vágó-, fúró-, csiszoló szerszámokhoz
használják.
Fullerének
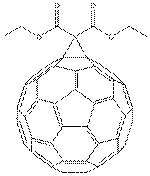
A fulleréneknek grafithoz hasonló
a szerkezetük, de nem tisztán hexagonálisak, hanem öt- és hétszögeket is
tartalmaznak, amiktől a grafit síkja szferikus, elliptikus vagy hengeres alakban torzul. Kémiai tulajdonágaikat még nem ismerjük
tökéletesen. Nevüket Buckminster Fullerről kapták.
Szén-monoxid (CO)
A szén-monoxid (CO) egy színtelen, szagtalan, íztelen gáz. A szénvegyületek tökéletlen égése során képződik, főleg belsőégésű motorokban. Üzemanyagnak is használható, levegővel jellegzetes kék lánggal ég. Annak ellenére, hogy mérgező, kiterjedten használják vegyipari alapanyagként. Kémiailag egy szénatom kötődik kovalens kötéssel egy oxigénatomhoz. Szobahőmérsékleten gáz halmazállapotú. Erősen mérgező.
Előállítása:
A szén-monoxid
előállítására többféle módszer létezik.
A szintézisgáz a vízgőz és szén endoterm
reakciójával jön létre:
H2O + C → H2 + CO ΔH
= 131 kJ/mol
CO előállítható
fém-oxidok szenes redukciójával is, ahogy azt az egyszerűsített ábra is mutatja
(M=fém):
MO + C → M + CO ΔH = 131 kJ/mol
Miután a CO gáz
lesz, a folyamat felgyorsítható hevítéssel.
Szerkezete:
A szén-monoxid
molekulában a szénatom két párosítatlan elektronja és az
oxigénatom párosítatlan elektronjai egy szigma-, és egy pi-kötést létesítenek. A
molekulában található harmadik pi-kötés mindkét elektronja az oxigénatomtól
származik, ez egy datív kovalens kötés. A molekulában a kötésrend három.A molekula két nemkötő elektronpárt tartalmaz,
egyik a szénatomhoz, másik az oxigénatomhoz tartozik.
A szén-monoxid
molekulája csaknem teljesen apoláros annak ellenére, hogy két különböző elektronegativitású atom kapcsolódik benne össze. Ez azzal magyarázható,
hogy a nagyobb elektronegativitású oxigénatom a donor (az az atom, amelyik az
elektronpárt adja), a kisebb elektronegativitású szénatom pedig az akceptor.
Emiatt nem jut érvényre a kötés poláros jellege.
Tulajdonságai:
Nehezen
cseppfolyósítható gáz. A sűrűsége közel áll a levegőéhez. A nitrogénmolekulával izoszter, ez
azt jelenti, hogy azonos a molekulák tömege és megegyezik a molekulát alkotó
atomok száma. Emiatt fizikai tulajdonságaik nagyon hasonlóak, közel áll
egymáshoz a sűrűségük, az olvadáspontjuk és a forráspontjuk. A
szén-monoxid vízben rosszul oldódik. Redukáló tulajdonságú. A szén-monoxid
molekulájában található két nemkötő elektronpár nem egyenértékű, a szénhez
tartozó elektronpár donor sajátságú. A szén-monoxid emiatt könnyen képez komplexeket, átmenetifémekkel képzett komplexeinek neve fém-karbonil. A hangyasav formális
anhidridjének tekinthető, mert hangyasavból kénsavval történő
vízelvonáskor szén-monoxid fejlődik, azonban a vízben oldásakor nem keletkezik
hangyasav.
![]()
A nátrium-hidroxid 100 °C körüli hőmérsékleten szén-monoxidot köt meg,
és a hangyasav nátriumsója, nátrium-formiát keletkezik.
![]()
A levegő oxigénje
hatására elég, szén-dioxid keletkezik. Ez a reakció vízgőznyomok hatására megy
végbe. Klórral nagyon mérgező
foszgénné
(karbonil-kloriddá) egyesül.
![]()
Ha a
szén-monoxid kéngőzökkel reagál, gáz
halmazállapotú karbonil-szulfid keletkezik. A karbonil-szulfid könnyen bomlik
szén-dioxiddá és szén-diszulfiddá.
![]()
Élettani hatása:
A szén-monoxid
nagyon mérgező gáz. Mérgező
hatása azzal magyarázható, hogy a vér hemoglobinjában található vasatomokkal stabil komplexet, szén-monoxid-hemoglobint képez,
ezzel a szervezet oxigénfelvételét és oxigénellátását akadályozza. A hemoglobin
akkor is megköti a szén-monoxidot, ha a levegő szén-monoxid
tartalma csekély. 250-szer nagyobb affinitással kötődik a vér hemoglobinjához,
mint az oxigén.[2]
- Azonnali hatása: fejfájás,
szédülés, émelygés, a látás- és hallásképesség csökkenése.[3]
- Tartós hatása: a szívizmot
ellátó koszorúerek keringését csökkenti, hozzájárulva a
koszorúér-elmeszesedéshez, szűkíti a koszorúereket, növeli a szívinfarktus kockázatát.[3]
Szén-monoxid-mérgezés
esetén szabad levegőn mesterséges
lélegeztetést kell
alkalmazni.
Szén-dioxid (CO2)
A szén-dioxid (CO2, régi
magyar nevén szénéleg) légköri nyomáson légnemű, gáz halmazállapotú vegyület. A tiszta levegő mintegy 0,039% (térfogatszázalék) szén-dioxidot (390 ppm) tartalmaz.[2] Ez a mennyiség az elmúlt évtizedekben jelentősen növekedett (100
éve még kb. 280 ppm volt), ami bizonyítottan hozzájárul a globális felmelegedéshez, azaz a szén-dioxid üvegházhatású
gáz.
A légkörbe számos forrásból kerülhet; szén és széntartalmú anyagok égése, állatok, növények és mikroorganizmusok légzése során keletkezik. Jelentős mennyiségű szén-dioxid kerül a
levegőbe a vulkanizmus során és a tengerek kötött szén-dioxidjából is.
A szén-dioxid ‒78 °C-on fagy meg, a szilárd halmazállapotának neve szárazjég.
A szárazjeget a hűtőipar is felhasználja, de látványosságként is alkalmazzák,
ahogy felmelegedve a folyékony halmazállapot kihagyásával gőzzé válik, azaz szublimál.
Kémiai és fizikai tulajdonságok:
Színtelen, kis koncentrációban szagtalan, a
levegőnél nagyobb sűrűségű. Ha a belélegzett levegő a normál koncentráció
többszörösét (néhány %-ot) tartalmazza szén-dioxidból, akkor azt enyhén
savanykásnak érezzük, ez a koncentráció azonban már veszélyes, mert fulladást
okozhat!
A tiszta
szén-dioxid nem éghető, az égést nem táplálja,
ezt a tulajdonságát használják ki a tűzoltó-készülékeknél, és a gyertyalángos
próbánál a pincék ellenőrzésénél, ha a gyertya kialszik, akkor a szén-dioxid
veszélyes mennyiségben van jelen a helyiségben. Reakciókban kevésbé vesz részt.
Vízben kismértékben
oldódik (0,145 g/100 ml), a vízzel gyenge szénsavat képez.
A légnemű halmazállapotú vegyület normál légköri
nyomás (1 bar) alatt ‒78,5 °C-on fagy meg, a folyékony halmazállapot kihagyásával.
5,1 bárnál nagyobb nyomáson előállítható viszont folyékony szén-dioxid is. A gázpalackokban is ilyen
állapotban tárolják. A szén-dioxidot szilárd halmazállapotát szárazjégnek
nevezzük. A sűrűsége standard hőmérsékleten és nyomáson körülbelül
1,98 kg/m³, másfélszer akkora mint a Föld légköréé. A szén-dioxid
molekula (O=C=O) két kettős kovalens kötést tartalmaz és egyenes az alakja. Nincs elektromos
dipólusmomentuma (apoláris). Nem reaktív és nem gyúlékony.
Felhasználása, gyártása:
Jelen van az
üdítőkben, szénsavas italok alkotórészeként, tűzoltó palackokban, hegesztésnél
inert gázként.
Cseppfolyós szén-dioxiddal vonják ki a koffeint a kávéból is.
Szilárd formában (szárazjég) mint
hűtőanyag, ott, ahol gyors mélyhűtésre van szükség, vagy nem áll rendelkezésre
hűtőgép.
A szén-dioxidot nagyobb mennyiségben bányásszák (Magyarországon 1982-ig a Kisalföldön, Mihályi mellett),
illetve kőolaj- és földgázkutakból tör fel, mint
melléktermék. Az így kapott gázt tisztítják, majd nagy nyomáson cseppfolyósítják, és
ebben a formában tárolják, szállítják. A cseppfolyós szén-dioxid hirtelen
nyomáscsökkenésekor a szublimációval történő gyors
párolgás (párolgáshő) annyira
lehűti az anyagot, hogy az megfagy, és szárazjég keletkezik.
Az élelmiszeriparban szívesen használják a tankerjesztésű pezsgők erjedése
során keletkező szén-dioxidot, ugyanis a pezsgő természetes
habzásához kevesebb is elég, mint amennyi abban keletkezik. A felesleget
üdítőkhöz, sörgyártásnál használják
fel.
A VIII. Magyar Gyógyszerkönyvben Carbonei dioxidum néven hivatalos.
A biogáz egyik jelentős
alkotórésze.
A szén
körforgása:
A növények képesek a
szén-dioxidot megkötni és a benne található szenet a saját szerves anyagaikba
beépíteni. A fa égésekor a nagy füstöt nem a szén-dioxid okozza, hanem a sok
elpárolgó víz, és a nitrogén-oxidok. A földtörténeti ókorban alakultak ki a
szénbányászatban jelentős, nagy kalóriatartalmú feketekőszén telepek az akkor
élt páfrányfélék, tengeri állatok maradékából, a földtörténeti újkorban pedig a
barnakőszén telepek (kisebb kalóriatartalom, a több szennyeződés miatt).
Több kevesebb szén található a
kőolaj- és földgázszármazékokban, a legjobb (legkörnyezetbarátabb) arány a
metánban (CH4) van: C:H=1:4. Ennél sokkal rosszabb az arány a
hosszabb szénláncokban: a cetán (C16H34) esetében már
csak C:H=1:2,125. Ezzel tehát jelentősen csökkenthető a CO2
kibocsátás, de már az is jelentős, ha PB gáz (propán (C3H8), bután (C4H10)) helyett metánt (vezetékes gáz)
használunk.

