
Elektronegativitás /ENE/
Megmutatja,
az atom mennyire vonzza a kötésben lévő elektronjait.
Viszonyszám, a hidrogénét 2,1-nek vették (jobban jársz, ha nem írom le miért), a
többi elemét hozzá viszonyítják, pl. klór 3,0 az oxigén 3,5 stb.
Mitől függ
a nagysága:
1.
Minél több elektron van a külső héjon annál nagyobb, ha tehát főcsoportok
versengenek, az I.A biztosan veszít, a VII.A biztosan nyer. (A VIII. főcsoport
nem játszik, adott a nemesgáz szerkezet, nincs is kötésben elektron).
2.
Minél több elektronhéj van, annál messzebb vannak a külső elektronok, mire
elérjük a 7. héjat, az atommag már alig vonzza a külső héj elektronjait.
Ha tehát az ENE balról jobbra és lentről felfelé nő, biztos, hogy a világ legkisebb ENE-ú eleme az Fr, legnagyobb a F (Periódusos rendszert kézbe ifjak!)
Kinek fáj mindez késő este?
Képzeld el, hogy egy szegény családban karácsonyra a két tesó egy ajándékot kap.
1. Ha azonos korúak, neműek, a játék kb, 50%-ban az egyiké, 50%-ban a másiké.
2. Ha az egyik idősebb és erősebb, a játék kicsit biztosan több időt tölt az ő környezetében.
3. Ha nem csak idősebb és erősebb, de érZelmi fogyatékos is, fejbe csapja a kicsit, azután csak övé a játék ( na ez majd az ionkötés lesz, ezzel nem ma foglalkozunk).
Nézzük az első esetet. Ha két azonos atom kapcsolódik, azok elektronegativitása is azonos. A kötő elektron kb. középen van, nincsenek pólusok. Az ilyen anyagok gázok, vagy ha folyadékok alacsony a forráspontjuk, ha szilárdak gyakran szublimálnak, alacsony hőmérsékleten olvadnak.

Miért? Mert a molekulák között elhanyagolható a kölcsönhatás. Az ilyen kovalens kötést APOLÁROS vagy másképp APOLÁRIS (ugyanaz) kovalens kötésnek nevezzük.
Nézzük a második esetet, az egyik tesó nagyobbacska: amelyik atom elhúzza maga felé a kötő elektront, a molekula azon része elektrontöbbletes, azaz negatív, ahonnan elhúzták elektronhiányos, azaz pozitív töltésű lesz. Az ilyen kötést POLÁROS vagy POLÁRIS kovalens kötésnek nevezzük. Ha a molekulának csak két pólusa van, DIPÓLUSMOLEKULA ( kétpólusú) jön létre. Nézzük:
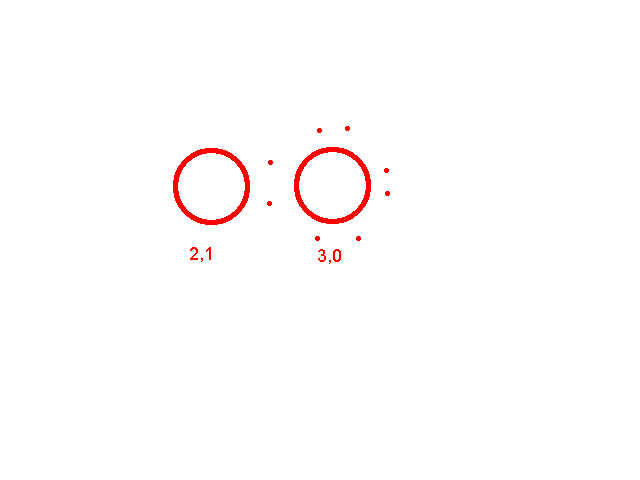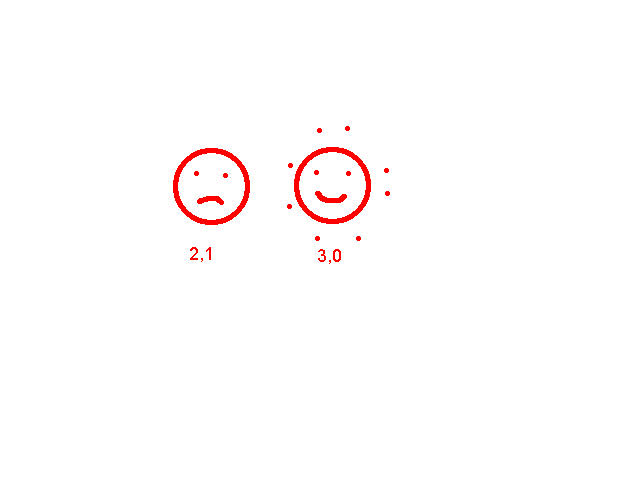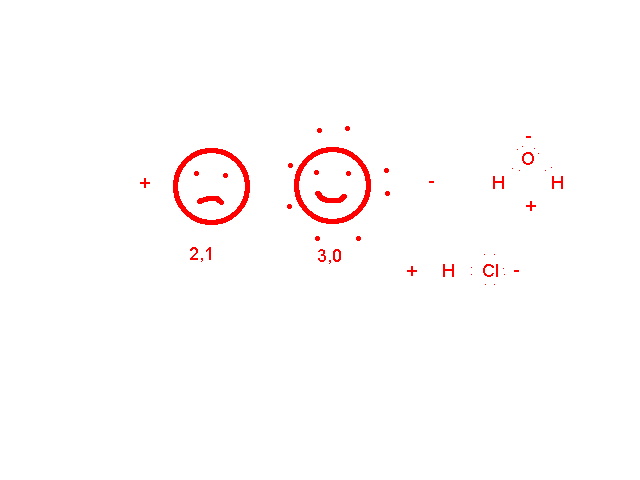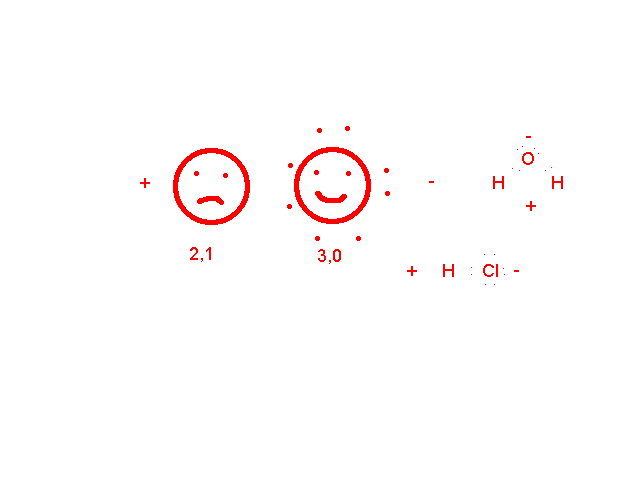
A poláris kötés már rendezi a molekulákat a halmazon belül, víz esetén a gyenge másodrendű kötések egy állandóan összeomló majd kiépülő kvázi kristályszerkezetet hoznak létre:
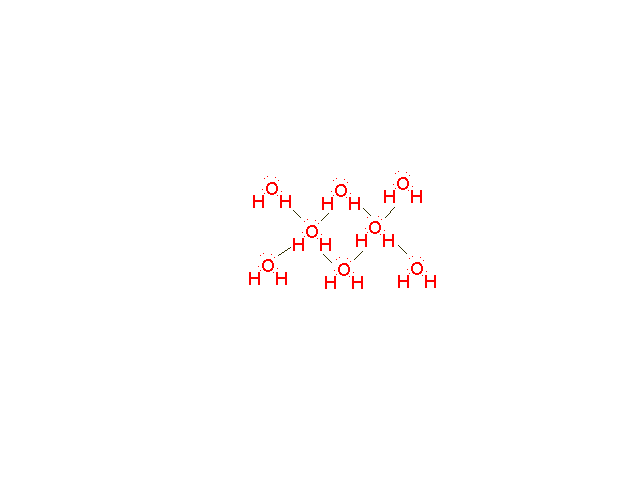
Ezek a kötések egyenként gyengék, de együtt elég erősek, ha nem hiszed ugorj hasast a medencébe.
Miért fontos ez: Az ammónia mólnyi tömege 17g, gyengén poláris, gáz, a szén-dioxid mólnyi tömege 44g, gyengén poláris, gáz, a víz mólnyi tömege 18g, erősen poláris, folyadék. Élet ott van, ahol a víz cseppfolyós állapotban létezni tud. Ha a víz kevésbe lenne dipólusmolekula, a földi élet (mai értelemben) nem is létezne.

Nézzük a zseniális tankönyvünket:
TK. 92. o. Lap alján a bal oldali ábrában a 10. rendszámú Ne alatti 7-es számot javítsd kihúzás jelre, a szerzőnek mindegy, nekünk nem az.
A TK 93. oldalán lévő kísérlet jobban működik, ha konyhában állítod gyengén csorgóra a hidegvizes csapot, fésű helyett pedig használj műszálas pulcsit és műanyag sínvonalzót ( azt az egyenest). Legyél gumitalpú papucsban, mert az szigetel, a dipólus vízmolekulákat taszítja a megdörzsölt műanyag vonalzó. Jó játékot, aki a működő kísérletet értékelhetően lefotózza, jutalmat kap. Valaki segít a családban. Kísérletezz, maradj otthon!