A nitrálás és nitrozálás elmélete
Nitrálásnak nevezzük azt a kémiai reakciót, melynek során NO2 (azaz nitro-csoportot) viszünk be egy szerves vegyületbe, és C-N kötést hozunk létre.
Ritkán kapcsolhatjuk a NO2-csoportot N-hez is.
Ha OH-csoport hidrogénjét cseréljük le NO2-csportra, akkor O-NO2 kötés jön létre, ez nem nitrálás, hanem észterezés. Így a nitroglicerin elnevezésű robbanóanyag neve helytelen, mert nem valódi nitro-vegyület, hanem csak salétromsav észter. A helyes neve tehát salétromsavas glicerinészter.
A nitrálás célja általában az, hogy a NO2-csoportot nagyon sok más csoporttá tudjuk átalakítani, illetve számos nitrovegyület kiváló oldószer (pl. nitrobenzol).
Sok olyan nitrovegyület van, amelynek egy molekulájában több nitrocsoport is szerepel, ezeket általában robbanóanyagoknak használják fel.
A nitrálószerrel alátámasztott legfontosabb követelmény az, hogy képes legyen a vegyületbe bevinni a NO2-csoportot.
A nitrálóreagens leggyakrabban a NO2+ (nitrónium-kation). Ez kisebb mértékben, megfordítható reakciónak köszönhetően jelen van a tömény salétromsavban is, azonban koncentrációja nagyon kicsi:
![]()
Ebből adódóan a salétromsav önmagában gyenge nitrálószer.
Hogy a nitrónium-kation koncentrációja kielégítő legyen, valamilyen anyaggal elősegítjük a képződését, leggyakrabban tömény kénsavval. E két sav keverékét nevezzük nitrálósavnak.
![]()
Ez már erélyes nitrálószer.
A nitrálósavnak nincsen konkrétan meghatározott összetétele, a nitrálásra kerülő vegyület dönti el, milyen összetételű nitrálósav szükséges.
A fenolt (mivel reakcióképes) már a 30%-os hideg salétromsav is nitrálja.
A benzolt (közepesen reakcióképes) csak a tömény salétromsavból és tömény kénsavból előállított nitrálósav nitrálja, melegen.
A nitrobenzol m-dinitrobenzollá való alakításához pedig 100%-os salétromsav és tömény kénsav elegye, valamint 100 oC szükséges (a nitrobenzol kevésbé reakcióképes).
Nitrálóreagensként használatos még az acetil-nitrát is, ez egy rendkívül robbanékony anyag, a reakcióelegyben közvetlenül állítjuk elő, ott helyben (in situ) fel is használódik, így veszélytelen. Előállítása úgy történik, hogy ecetsav-anhidrides közegben nitrálunk, és réz(II)-nitrátot adagolunk részletekben a reakcióelegybe. Ebből felszabadul az acetil-nitrát, és a nitrálandó vegyületet azonnal nitrálja.
Kíméletes nitráló reagens, de éppen emiatt használata korlátozott, csak a reakcióképes anyagok nitrálhatóak vele, viszont mellékreakcióktól (oxidáció, több nitrocsoport belépése) nem kell tartani.
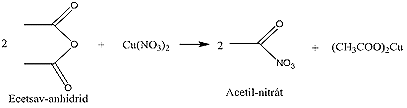
Ezen kívül speciális esetekben nitráláshoz használják még a N2O4-ot is.
Nitrálásra kerülő vegyületek:
- Alkánok: Régen az alkánokról azt hitték, hogy nem nitrálhatóak. Ez olyan szempontból igaz, hogy a klasszikus nitrálósavval nem reagálnak, azonban később rájöttek, hogy salétromsavval gőzfázisban, magas hőmérsékleten nitro-alkánok keletkeznek. Az iparban így állítják elő a nitro-metánt is.
Régen viszont (és laboratóriumi méretekben ma is) kerülő úton lehet előállítani ezeket a vegyületeket, halogénezett karbonsavakból, majd a keletkezett nitro-karbonsav dekarboxilezésével (CO2-lehasítás). Erre példa a nitro-metán előállítása monoklór-ecetsavból:
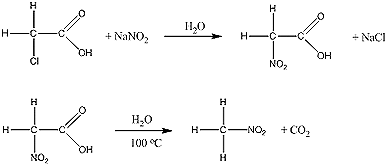
Ez a reakció csak laboratóriumban gazdaságos.
Az iparban a fent említett reakciót végzik el:
![]()
- Az aromás vegyületek nitrálása a halogénezésnél már ismertetett aromás elektrofil szubsztitúció szerint történik.
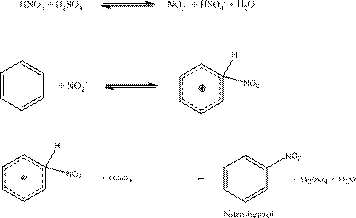
Összegezve:
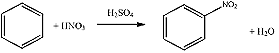
Mivel a reakció során víz képződik, a nitrálási reakciók exotermek, különösen a reakció elején, amikor a nitrálósav még tömény.
Sok olyan eset van, amikor sem a nitrálandó vegyület, sem a nitrotermék nem oldódik a nitrálósavban, ilyenkor a reakció fázishatáron megy végbe.
Éppen a fentiekben leírtak miatt fontos a nitrálásnál az állandó keverés, illetve azért is, mert a fázishatáron lejátszódó reakciók esetén helyi túlhevülések jöhetnek létre, amik robbanáshoz is vezethetnek, főleg nagyobb méretek esetében.
A nitrálóelegy összetételét, illetve a nitrálás során alkalmazott hőmérsékletet a nitrálandó vegyület minősége, és a bevitelre szánt nitrocsoportok száma is megszabja.
Általánosságában elmondható, hogy a kevésbé reakcióképes vegyületekhez töményebb nitrálósav (nem ritkán 100%-os HNO3 és oleum keveréke), illetve magasabb hőmérséklet szükséges.
A reakció végén eljutunk egy olyan pontra, amikor a nitrálóelegyből a salétromsav szinte teljesen elfogyott, a kénsav pedig (a reakció során keletkező víz miatt) felhígult. Ezt a savat hulladéksavnak nevezzük, már nem alkalmas nitrálásra. Az iparban ezt természetesen betöményítik, a laboratóriumokban nem szokás regenrálni.
A nitrálás után nagyon fontos a savnyomoktól mentesíteni a nitroterméket. Ennek módja minden esetben adott, általában vizes, lúgos, karbonátos mosással történik.
Különösen ügyelni kell erre akkor, ha a terméket alkoholból kívánjuk átkristályosítani, ugyanis a salétromsav az alkohollal erősen robbanó etil-nitrátot (salétromsavas etilésztert) képez. Ha a savnyomokat a vegyületből gondosan eltávolítottuk, ez a veszély nem fenyeget.
A nitrálást befolyásolja a hőmérséklet, és a nitrálóelegy összetétele, aránya a nitrálásra kerülő vegyülethez, és a nitrálandó vegyület minősége.
A hőmérséklet emelkedése többszörösen nitrált termékek keletkezésének kedvez, és a salétromsav oxidáló hatása is előtérbe kerül.
A nitrozálás
Nitrozálásnak nevezzük azt a kémiai reakciót, melynek során egy szerves vegyületbe NO (azaz nitrozo)- csoportot viszünk be.
A NO-csoport bevitele történhet C-atomra, illetve N-atomra is. Ha N-atomra kerül a NO-csoport, akkor N-nitrozálásról beszélünk.
A nitrozáló reagensünk a salétromossavból kénsav segítségével előállított NO+ , azaz nitrozil-kation.
A salétromossav azonban csak alacsony hőmérsékleten, híg vizes oldatban stabil, ennek következtében a nitrozálásnál nem tudunk magas NO+ koncentrációt nyerni. Ebből az következik, hogy nitrozálni csak a nagyon reakcióképes aromás vegyületeket lehet, melyek már ilyen alacsony NO+ koncentráció és alacsony hőmérséklet mellett reagálnak.
Mivel a salétromossav rendkívül bomlékony, a sóiból állítjuk elő közvetlenül a reakcióelegyben. Erre leggyakrabban nátrium-vagy kálium-nitritet használunk.
Nitrozálható vegyületek tehát a fenolok, ezekben az esetekben orto- vagy para-nitrozó-fenolok képződnek.
Nitrozálhatóak még a szekunder aminok, ilyenkor N-nitrozó-vegyületek képződnek (a nitrozo-csoport a N-atomhoz kapcsolódik), illetve a tercier aminok, amikoris a nitrozo-csoport az aromás gyűrűbe lép be, para helyzetbe.
Az elsőrendű aminok is reagálnak a salétromossavval, de ez nem nitrozálás, hanem a diazotálás (ld. ott!).
A NO+ kation kiépülését a nitrozálás mechanizmusát a fenol nitrozálásának a példáján mutatjuk be:
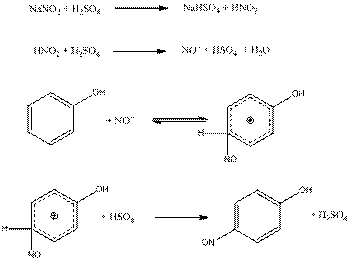
Ebben az esetben p-nitrozó-fenolt nyerünk.