|
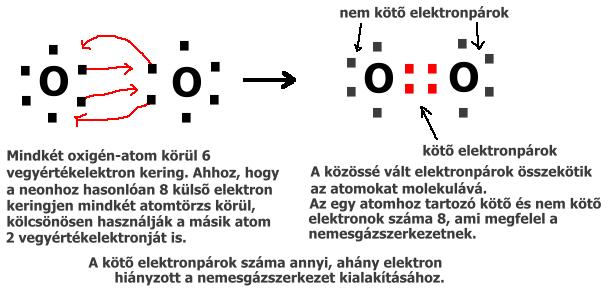
Összefoglalás - 2. KÉMIAI KÖTÉSEK A nemesgázok kivételével az atomok egymással összekapcsolódva fordulnak elő. Az összekapcsolódó atomok kisebb energiaszintre kerülnek és közös elektronszerkezetük a nemesgázokéhoz válik hasonlóvá. ELSŐDLEGES KÉMIAI KÖTÉSEK Nagy elektronvonzó képességű nemfém-atomok között alakul ki, úgy, hogy a vegyérték-elektronokból kötő elektronpárok képződnek. Egy-egy atomnál annyi kötő elektronpár jön létre, amennyi e– hiányzik a nemesgáz-szerkezet kialakításához. A kötő elektronpárokkal összekapcsolódó atomok molekulákat vagy atomrácsos kristályt (gyémánt, grafit) hoznak létre. Pl.: az oxigénmolekula kialakulása:
A molekulákat képlettel
jelöljük.
A képlet fajtái: Pl.: A klórmolekula képlete: Cl2 (2 klóratomból áll). A szén-dioxid-molekula képlete: CO2 (1 szénatom és 2 oxigénatom kapcsolódik össze) * SZERKEZETI KÉPLET: kifejezi az atomok összekapcsolódásának módját és a molekula térbeli szerkezetét. Az atomok jelét annyiszor írjuk le, ahány darab alkotja a molekulát, kapcsolódásukat a vegyértékelektronok feltüntetésével jelezzük. Ez történhet egyenként pontokkal, vagy párosával, vonalakkal. 
Mivel a klór molekulájában két szomszédos atom között egy kötő elektronpár létesít kapcsolatot, a kovalens kötés egyszeres. A szén-dioxid molekulájában a szén és az oxigén atomja között két elektronpár létesít kapcsolatot, ezért itt kétszeres kovalens kötésről beszélünk. FÉMES KÖTÉS
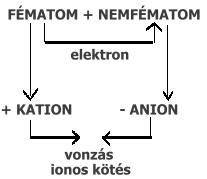
IONOS KÖTÉS
Ionos kötéssel ionrácsos kristályok jönnek létre. (kősó)Az ionok jelölése úgy történik, hogy a vegyjel jobb felső sarkába felírjuk a töltésszámot és a töltést. A töltésszám megmutatja, hogy hány elektron leadásával vagy felvételével alakult az atom ionná: A fémionok + töltésűek: Ca2+ = kalcium-ion, Na+ = nátrium-ion (az 1-es számot nem írjuk ki) A nemfémionok – töltésűek: Cl– = klorid-ion, O2– = oxidion (a kationok neve -id végződésű) Az ionvegyületek nevét úgy képezzük, hogy a kation neve után az anion nevét mondjuk: NaCl = nátrium-klorid, Na2O = nátrium-oxid. Az ionvegyületeknek csak összegképlete van. Ez akkor helyes, ha az ionok olyan arányban szerepelnek benne, hogy a töltésszámok össze 0 (az ionvegyületek nem mutatnak elektromos töltést). Az ionok arányát a vegyjel jobb alsó sarkához írt indexszám fejezi ki: Ca2+O2- = az ionok aránya 1:1, mert 1 Ca2+ 2+ töltése kiegyenlíti az 1 db O2- 2– töltését. Ca2+Cl–2 = az ionok aránya 1:2, mert 1 Ca2+ 2+ töltését 2 db Cl– 1– töltése egyenlíti ki. MÁSODLAGOS KÉMIAI KÖTÉSEK
|