|
Összefoglalás - 3. KÉMIAI REAKCIÓK A kémiai reakciók az anyag átalakulásával járó kölcsönhatások. Ezek a kémiai kötések megváltozásával járnak. A kötések megváltozása mindig energiaváltozással jár.
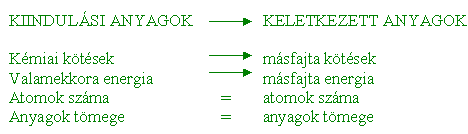
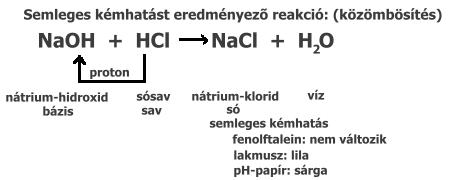
A reakciókat egyenlettel jelöljük. A kiindulási anyagok és a reakciótermékek kémiai kötései eltérők, de az anyagok atomjainak száma és a tömegek azonosak. Tömegmegmaradás törvénye: a kémiai reakciókban a kiindulási anyagok tömegének összege egyenlő a keletkezett anyagok tömegének összegével. Az egyenlet jelentései: * Milyen átalakulást jelöl (minőségi jelentés) * Hány darab atom vagy molekula reagál egymással (mennyiségi jelentés) * Hány mol anyag reagál egymással (mennyiségi jelentés) Az egyenletszerkesztés lépései: Ha nem egyenlők ® 4. 4. Rendezzük az egyenletet: a képletek elé olyan számokat írunk, amelyek egyenlővé teszik a kiindulási és a keletkezett anyagok atomjainak számát. Pl.: A magnézium égésének egyenlete: 2. Mg + O2 ® MgO 3. A bal oldalon 1 Mg-atom és 2 O-atom van, a jobb oldalon 1 Mg-atom és 1 O-atom. Mivel az atomok száma különbözik, jön a 4. lépés. 4. Mivel a MgO-ban 1 Mg és 1 O-atom kapcsolódik, a bal oldalon levő 2 O-atom miatt 2-szeres mennyiségő MgO-t veszünk (elébe írunk egy 2-est). Ekkor azonban nemcsak O-ből, hanem Mg-ból is 2 db lesz. Az egyenlőség miatt a bal oldalon levő Mg elé is egy 2-est kell írnunk: 2 Mg + O2 ® 2 MgO Ekkor az atomok száma a nyíl jobb és bal oldalán egyenlő lett, vagyis az egyenletünk kész. A REAKCIÓK TÍPUSAI A résztvevő anyagok száma szerint: C + O2 ® CO2 b., Bomlás: egy anyagból több lesz 2 H2O ® 2 H2 + O2 Energiaváltozás szerint: Fe + S ® FeS (a folyamat hőt termel) b., Endoterm: energiaigénylő (a környezet energiája csökken, az anyagé nő) C + CO2 ® 2 CO (a reakció akkor megy végbe, ha melegítjük) Részecskeátmenet szerint: e–-átmenettel jár. Az e–-t leadó anyag oxidálódik, az e–-t felvevő redukálódik. Az elektront leadó anyag redukálószer, az elektront felvevő oxidálószer. * Teljes elektronátmenet ® ionkötést eredményez.  * A részleges elektronátmenet (elektroneltolódás) ® poláris kovalens kötést eredményez. b., SAV-BÁZIS-REAKCIÓ: (Protolítikus reakció):
|