Összefoglalás - 4.
KÉMIAI SZÁMÍTÁSOKA kémiai jelölések mennyiségi jelentése alapján különböző számításokat
végezhetünk.
1., ANYAGMENNYISÉG
Az anyagmennyiség jele: n, egysége
1 mol. 1 mol = 6*1023 db részecske együttese.
AZ ANYAGOK MOLTÖMEGE:
Nemesgázokat és a fémeket vegyjellel jelöljük. Ezek 1 moljának tömege
azonos a tömegszámmal.
Pl.: 1 mol Ne = 20 g, 1 mol vas = 56
g.
A vegyületek moltömegét az alkotó atomok, ionok tömegének összege
adja. Ha egy atomfajtából több is van (ezt az indexszám mutatja), annak tömegét
többször vesszük:
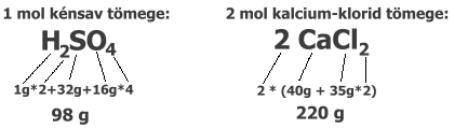
Ha nem egy mol anyagunk van, a mólok számát a vegyjel vagy képlet elé írjuk,
és ezzel a számmal szorozzuk az egy mol anyag tömegét.
2., EGYENLETEK ALAPJÁN TÖRTÉNŐ SZÁMÍTÁSOK
A kémiai egyenletek adott tömegű
(arányú) anyagok reakcióját írják le. A jól felírt egyenlet alapján számításokat
végezhetünk.
Lépések:
|
a., A feladat értelmezése: |
Pl.: Hány gramm magnéziumot kell elégetni 8 gramm magnézium-oxid
előállításához? |
|
b., A szükséges egyenlet hibátlan felírása: |
A magnézium égésének egyenlete:
2 Mg + O2 ® 2 MgO |
|
c., A kérdésben szereplő anyagok kijelölése (pl. aláhúzással): |
2 Mg + O2 ®
2 MgO
|
d., A kijelölt anyagok tömegének felírása (vagyis feltüntetjük,
hogy az egyenlet szerint hány gramm anyagból mennyi reakciótermék jön
létre):
|
2*24g ® 2*(24g+16g)
48g ® 80g |
|
e., Ezután a megfelelő helyre felírjuk a kérdésben szereplő
anyag tömegét, és kijelöljük a számítandó mennyiséget: |
X ® 8 g |
|
f., Számítás következtetéssel (egyszerűbb esetben) egyenes arányosság
alapján. |
Ha 80 g MgO 48 g Mg-ból keletkezik, akkor 8 g MgO 4,8 g Mg-ból (0,1
résznyi termék 0,1-szeres kiindulási anyagból) |
|
g. Számítás matematikai módszerrel, egyenlet alapján: |
Az egymás alá írt számokból törtet képezünk, és közéjük
egyenlőségjelet írunk:
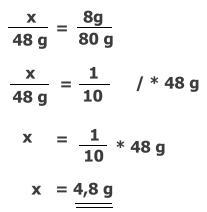 |
Pl.: Számítsuk ki, hány g 20 %-os kénsav old fel 6,5 g cinket!

Mivel a kérdésben szereplő kénsav 20 %-os, a kapott eredmény még nem végeredmény,
mert ez a 9,8 g kénsav a cinket oldó vízmentes kénsav tömege. Mivel a 20
%-os kénsavnak nagy része víz (pontosan 80 %-a) és a víz nem oldja a
cinket, ezért a híg kénsavból többet kell használni, mint a töményből.
Jelen esetben a 9,8 g a kénsavoldat 20 %-át teszi ki, így a teljes kénsav
mennyiségét a következőképpen számítjuk ki:
Ha 9,8 g = 20 %, akkor
x = 100 %.
Ebből egyenletet képezve és x-et kiszámítva, 9,8 g * 5 = 49 g kénsavoldatot
kapunk.
3. SZÁZALÉKOS SZÁMÍTÁSOK
a., Vegyületek összetétele
Abból indulunk ki, hogy a vegyület
1 moljának tömege a 100 %, és azt keressük, hogy az adott alkotórész tömege
ennek hány %-a.
Pl.: Számítsuk ki, hány % oxigén
van az égetett mészben!

b., Oldatok töménysége
Az oldatok oldószerből és
oldott anyagból álló keverékek.
Egy oldat annyi tömeg %-os (m/m %), ahány %-át teszi ki az oldott anyag.
Pl.: egy oldat akkor 23 m/m %-os, ha
az egész oldat tömegének 23 %-a az oldott anyag, a többi (77 %) oldószer.
A tömeg % kiszámításának módja:

Pl.: Hány m/m %-os az az oldat,
amelyet úgy készítünk, hogy 2 mol konyhasót feloldunk 1 liter vízben?

Vissza * Előre
GYAKORLÓ
FELADATOK
|
